
 綠礬是一種重要的化工原料.
綠礬是一種重要的化工原料.分析 【問題1】(1)鐵離子遇KSCN溶液為血紅色;
(2)亞鐵離子具有還原性,能被高錳酸鉀氧化;
(3)防止Fe3+的干擾,可以加入適量鐵粉進行除雜,Fe與鐵離子反應生成亞鐵離子;
(4)從FeSO4溶液中得到綠礬晶體,蒸發濃縮、冷卻結晶,蒸發需要蒸發皿、玻璃棒等,過濾需要燒杯、漏斗等;
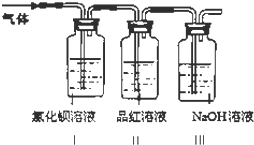
【問題2】為檢驗FeSO4高溫分解的氣體產物中是否含有SO2和SO3,由實驗裝置可知,氣體進入I中反應生成白色沉淀硫酸鋇,II中二氧化硫可使品紅褪色,III為尾氣處理裝置,可利用NaOH溶液吸收二氧化硫,以此來解答.
解答 解:【問題1】(1)綠礬中的亞鐵離子被氧化成鐵離子,遇KSCN變紅色,因此加入KSCN溶液,若溶液變紅證明被氧化,故答案為:KSCN;
(2)酸性KMnO4可氧化亞鐵離子,但不與鐵離子反應,若溶液的紫色不褪去,證明已完全被氧化,故答案為:溶液不褪色;
(3)鐵與鐵離子反應生成亞鐵離子,離子方程式為Fe+2Fe3+=3Fe2+,故答案為:Fe+2Fe3+=3Fe2+;
(4)從溶液中得到晶體的第一步是蒸發濃縮,然后冷卻結晶、過濾、自然干燥即可;這一系列的操作中A、蒸發皿中進行蒸發,C、燒杯中配成溶液,D、用玻璃棒進行攪拌,沒有用的是B石棉網,
故答案為:蒸發濃縮;B;
【問題2】為檢驗FeSO4高溫分解的氣體產物中是否含有SO2和SO3,由實驗裝置可知,氣體進入I中反應生成白色沉淀硫酸鋇,II中二氧化硫可使品紅褪色,III為尾氣處理裝置,可利用NaOH溶液吸收二氧化硫,
(1)三氧化硫與氯化鋇溶液反應生成硫酸鋇白色沉淀,所以裝置I中氯化鋇溶液中可觀察到現象是有白色沉淀產生;2.33g為硫酸鋇,其物質的量為$\frac{2.33g}{233g/mol}$=0.01mol,即三氧化硫的物質的量為0.01mol,根據2(FeSO4•7H2O)═Fe2O3+SO2↑+SO3↑+14H2O~2e-可知該過程中轉移電子的物質的量為0.02mol,
故答案為:有白色沉淀產生;0.02;
(2)裝置II中試劑為品紅溶液,其作用是檢驗產生的氣體中是否含SO2,故答案為:檢驗產生的氣體中是否含SO2;
(3)裝置III中試劑為NaOH溶液,其作用是除去多余的SO2,防止污染空氣,故答案為:除去多余的SO2,防止污染空氣.
點評 本題考查物質的制備實驗及性質實驗,為高頻考點,把握物質的性質、氧化還原反應、實驗裝置的作用為解答的關鍵,側重分析與實驗能力的綜合考查,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室用苯和濃硝酸、濃硫酸發生反應制取硝基苯的裝置如圖所示.回答下列問題:
實驗室用苯和濃硝酸、濃硫酸發生反應制取硝基苯的裝置如圖所示.回答下列問題: ;反應類型:取代反應
;反應類型:取代反應查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時儲氫合金作正極 | |
| B. | 充電時儲氫合金作負極 | |
| C. | 充電時陽極周圍c(OH-)減少 | |
| D. | 放電時負極反應為LaNi5H6-6e-═LaNi5+6H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com