
分析 (1)pH=-lgc(H+)來計算;
(2)醋酸是弱電解質,不能完全電離;
(3)化學式相似的物質的溶度積常數越小,則物質越難溶,根據沉淀的轉化的角度分析;
(4)pH=13的Ba(OH)2溶液中氫離子都是由水電離產生,水電離產生的c(H+)等于溶液中水電離出c(OH-);
(5)設鹽酸的物質的量濃度為:C(HCl),堿與酸體積分別為1L、9L,分別求出氫氧化根離子和氫離子的物質的量,二者發生酸堿中和,所得溶液pH=11可知堿剩余,求出剩余的氫氧根離子的物質的量,依據:Kw=c(H+)×c(OH -)計算解答.
(6)反應前和反應后元素和醋酸溶液中氫離子濃度相等,根據醋酸為弱電解質、鹽酸為強電解質分析消耗鋅的質量大小.
解答 解:(1)鹽酸為強酸,0.1mol/L的鹽酸,PH=-lgc(H+)=-lg0.1=1,
故答案為:1;
(2)常溫下,某醋酸溶液的pH=1,根據PH=-lgc(H+),c(H+)=0.1mol/L,醋酸為弱電解質,在溶液中部分電離,其濃度大于0.1mol/L,
故答案為:>;
(3)在AgCl飽和溶液中加入足量濃NaBr溶液可生成AgBr沉淀,說明AgBr比AgCl更難溶,說明Ksp(AgCl)>Ksp(AgBr),
故答案為:>
(4))pH=13的Ba(OH)2溶液中氫離子由水電離產生,水電離產生的c(H+)等于溶液中水電離出c(OH -),故水電離出c(OH -)=c(H+)=10-13mol/L,
故答案為:10-13 mol•L-1;
(5)設鹽酸的物質的量濃度為:C(HCl),堿與酸體積分別為1L、9L,則n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,反應后剩余氫氧根離子的物質的量為:0.1mol-c(HCl)×9L;有混合所得溶液pH=11,可知混合后c(H+)=10-11 mol•L-1,則混合后c(OH -)=$\frac{{K}_{w}}{C({H}^{+})}$=10-3 mol•L-1,
即:$\frac{0.1mol/L-C(HCl)×9L}{10L}$=10-3 mol•L-1,解得:c(HCl)=10-2mol•L-1,pH=-lg[H+],所以pH=2,
故答案為:2
(6)鹽酸和醋酸的pH變化都是由2到4,鹽酸中氫離子濃度逐漸減小,但醋酸中存在電離平衡,氫離子和鋅反應時促進醋酸電離,補充反應的氫離子,所以醋酸是邊反應邊電離H+,而反應后溶液的pH相等,則氫離子濃度相等,所以反應過程中醋酸消耗的Zn多,即:消耗鋅的質量m1<m2,
故答案為:<.
點評 本題考查了溶液酸堿性與溶液pH的計算、弱電解質的電離平衡等知識,題目難度中等,注意掌握溶液酸堿性與溶液pH的計算方法,明確弱電解質在溶液中部分電離的特點.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 2 molKClO3 | B. | 22.4LHCl氣體 | C. | 2 molNaCl | D. | 1 mol AlCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子數 | B. | 顏色 | C. | 原子數 | D. | 密度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
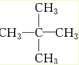 ,名稱為2,2-二甲基丙烷(新戊烷).
,名稱為2,2-二甲基丙烷(新戊烷).
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2S+SO2═3S↓+2H2O | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2NaBr+Cl2═2NaCl+Br2 | |
| D. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com