
【題目】根據所學知識,完成下列各題:
(1)在標準狀況下,氣體A的密度為3.17gL﹣1 , 則氣體A的摩爾質量為;
(2)用潔凈的燒杯取少量蒸餾水,用酒精燈加熱至沸騰,向燒杯中逐滴加入某種物質M的飽和溶液,繼續煮沸可制得一種紅褐色膠體. ①物質M的名稱為 .
②下列關于M的水溶液和上述操作所得膠體的敘述,正確的是
A.M的水溶液是電中性的,所得膠體是帶電的
B.二者分散質的粒子都不能透過半透膜
C.二者可用丁達爾效應區別
D.向兩者中逐滴滴加鹽酸溶液均無明顯現象
若膠體中含有雜質M則可用法提純此分散系.
(3)同溫同壓下,同體積的CO2和CO,它們的分子數之比為 , 物質的量之比為 , 密度之比為 .
(4)V L硫酸鋁溶液中含有m gAl3+ , 則溶液中SO42﹣的物質的量濃度是molL﹣1 , 硫酸鋁的物質的量濃度是molL﹣1
(5)在標準狀況下,由CO和CO2組成的混合氣體8.96L,質量是16g.此混合物中CO和CO2的物質的量比是 , CO的體積分數是 , C和O的原子個數比是 .
(6)3.01×1023個OH﹣的質量為 , 含有電子的物質的量為 , 和克Na+含有的離子數相同.
(7)欲除去粗鹽中的Ca2+ , Mg2+ , SO42﹣等雜志,溶解后可依次加入、、 , 過濾出沉淀后再加入 , 蒸發結晶即可.(填寫化學式)
【答案】
(1)71g/mol
(2)氯化鐵;C;滲析
(3)1:1;1:1;11:7
(4)![]() ;
; ![]()
(5)1:3;25%;4:7
(6)8.5g;5mol;11.5
(7)BaCl2;NaOH;Na2CO3;HCl
【解析】解:(1)在標準狀況下,氣體A的密度為3.17gL﹣1,則氣體A的摩爾質量M=ρVm=3.17gL﹣1×22.4L/mol=71g/mol,
所以答案是:71g/mol;(2)用潔凈的燒杯取少量蒸餾水,用酒精燈加熱至沸騰,向燒杯中逐滴加入某種物質M的飽和溶液,繼續煮沸可制得一種紅褐色膠體,該膠體是氫氧化鐵膠體,①實驗室用氯化鐵溶液制取氫氧化鐵膠體,所以M名稱是氯化鐵,所以答案是:氯化鐵;②A.M的水溶液是電中性的,膠體不導電,膠粒帶電,故錯誤;
B.溶液能透過半透膜,膠體不能透過半透膜,故錯誤;
C.膠體具有丁達爾效應,溶液沒有丁達爾效應,故正確;
D.將膠體中加入電解質溶液或產生聚沉現象,故錯誤;
故選C;
溶液能透過半透膜,膠體不能透過半透膜,所以若膠體中含有雜質M則可用滲析法提純此分散系,
所以答案是:C;滲析;(3)同溫同壓下,氣體摩爾體積相等,同體積的CO2和CO物質的量相等,物質的量之比為1:1,它們的分子數之比等于物質的量之比=1:1,密度之比等于摩爾質量之比=44g/mol:28g/mol=11:7,
所以答案是:1:1;1:1;7;(4)V L硫酸鋁溶液中含有mg Al3+,鋁離子的物質的量= ![]() =
= ![]() mol,c(Al3+)=
mol,c(Al3+)= ![]() =
= ![]() mol/L,該溶液中鋁離子和硫酸根離子的物質的量濃度之比等于其系數之比=2:3,c(SO42﹣)=
mol/L,該溶液中鋁離子和硫酸根離子的物質的量濃度之比等于其系數之比=2:3,c(SO42﹣)= ![]() c(Al3+)=
c(Al3+)= ![]() ×
× ![]() mol/L=
mol/L= ![]() mol/L;
mol/L;
根據原子守恒得c[Al2(SO4)3]= ![]() c(Al3+)=
c(Al3+)= ![]() ×
× ![]() mol/L=
mol/L= ![]() mol/L,
mol/L,
所以答案是: ![]() ;
; ![]() ;(5)在標準狀況下,由CO和CO2組成的混合氣體8.96L,質量是16g,
;(5)在標準狀況下,由CO和CO2組成的混合氣體8.96L,質量是16g,
設CO和CO2的物質的量分別是xmol、ymol
則 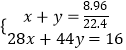
![]() ,
,
所以CO和CO2的物質的量之比=0.1mol:0.3mol=1:3;
根據V=nVm知,其體積之比等于物質的量之比,所以CO的體積分數等于其物質的量分數= ![]() =25%;
=25%;
該混合氣體中C、O原子個數之比等于其物質的量之比=(0.1+0.3)mol:(0.1+0.3×2)mol=4:7,
所以答案是:1:3;25%;4:7;(6)3.01×1023個OH﹣的物質的量= ![]() =0.5mol,其質量m=nM=0.5mol×17g/mol=8.5g,每個氫氧根離子中含有10個電子,所以含有電子的物質的量為5mol;和Na+含有的離子數相同,說明二者物質的量相等,鈉離子的質量m=nM=0.5mol×23g/mol=11.5g,
=0.5mol,其質量m=nM=0.5mol×17g/mol=8.5g,每個氫氧根離子中含有10個電子,所以含有電子的物質的量為5mol;和Na+含有的離子數相同,說明二者物質的量相等,鈉離子的質量m=nM=0.5mol×23g/mol=11.5g,
所以答案是:8.5g;5mol;11.5;(7)欲除去粗鹽中的Ca2+,Mg2+,SO42﹣等雜志,溶解后可依次加入氯化鋇除去硫酸根離子、NaOH除去鎂離子、碳酸鈉除去鈣離子和過量鋇離子,最后過濾出沉淀后再加入稀鹽酸,蒸發結晶即可,
所以答案是:BaCl2;NaOH;Na2CO3;HCl.
【考點精析】解答此題的關鍵在于理解膠體的重要性質的相關知識,掌握膠體的性質:①丁達爾現象(可用來鑒別膠體和溶液) ②布朗運動 ③電泳現象 ④膠體聚沉(加入電解質、加入帶異種電荷的膠體、加熱,均可使膠體聚沉).


科目:高中化學 來源: 題型:
【題目】I.根據所學知識,回答下列問題:
(1)元素周期表1~20號元素中,金屬性最強的元素是______(填元素符號,下同);屬于稀有氣體的是_________;非金屬性最強的元素在周期表中的位置是__________________。
(2)己知NO2和N2O4之間發生可逆反應:2NO2(g)(紅棕色)![]() N2O4(g)(無色)。將裝有NO2和N2O4混合氣體的燒瓶浸入熱水中,觀察到的現象是_______,產生該現象的原因是________。
N2O4(g)(無色)。將裝有NO2和N2O4混合氣體的燒瓶浸入熱水中,觀察到的現象是_______,產生該現象的原因是________。
(3)一定條件下,向2L恒容密閉容器中按體積比1:3充入4.48L(標準狀況)N2和H2的混合氣體,發生反應N2(g)+3H2(g)![]() 2NH3(g),5min時反應達到平衡狀態,測得c(N2)=0.02mol/L。
2NH3(g),5min時反應達到平衡狀態,測得c(N2)=0.02mol/L。
①0~5min內,v(NH3)=_______________。
②下列敘述可證明上述反應達到平衡狀態的是________(填序號)。
a.V(H2)=3v(N2)
b.容器內壓強保持不變
c.每消耗ImolN2,同時生成2molNH3
d.N2、H2和NH3的物質的量濃度不再變化
II.五種短周期元素A、B、C、D、E的原子序數依次增大,A和C同族,B和D同族,C的簡單離子和B的簡單離子具有相同的電子層結構。A和B、D、E均能形成共價型化合物。A和B形成的化合物在水中呈堿性,C和E形成的化合物中陰陽離子的個數比為1:1。回答下列問題:
(1)五種元素中,原子半徑最大的是______(填元素名稱),非金屬性最強元素的是_________。
(2)由元素A分別和元素B、D、E所形成的共價型化合物中,熱穩定性最差的是_____(用化學式表示)。
(3)元素A和E形成的化合物與元素A和B形成的化合物反應,產物的電子式為______,其中存在的化學鍵類型為______________。
(4)E離子的結構示意圖是____________;元素D最高價氧化物的水化物的化學式為_____。
(5)單質E與水反應的離子方程式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2L甲氣體和1L Y2氣體恰好完全反應生成2L XY2氣體(所有氣體的體積在標準狀況下測定)。則甲的分子式可能是( )
A.X2B.XYC.YX2D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某脂肪族化合物A的相對分子質量為118,其中C的質量分數為41%,H為5%,O為54%.化合物A能與碳酸氫鈉溶液反應放出氣體,也能與新制氧氧化銅懸濁液反應生成磚紅色沉淀,符合條件的A的醇羥基同分異構體有( )
A.2種
B.3種
C.4種
D.5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,標準狀況下某O2和N2的混合氣體mg含有b個分子,則ng該混合氣體在相同狀況下所占的體積應是( )
A.![]() L
L
B.![]()
C.![]()
D.![]() L
L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下,1.7g氨氣所占的體積為 L,它與標準狀況下 L硫化氫含有相同數目的氫原子.
(2)某氣態氧化物的化學式為RO2 , 在標準狀況下,1.28g該氧化物的體積為448mL,則該氧化物的摩爾質量為 ,R的相對原子質量為 .
(3)已知CO、CO2的混合氣體質量共16.0g,標準狀況下體積為8.96L,則可推知該混合氣體中含CO g,所含CO2在標準狀況下的體積為 L.
(4)同溫同壓下,SO2與氦氣的密度之比為 ;若質量相同,兩種氣體的體積比為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,下列敘述正確的是( )
A.標準狀況下,18gD2O中所含的質子數為10NA
B.標準狀況下,11.2LO2參加反應轉移的電子數一定為2NA
C.28gN2和CO的混合氣體中含有的分子數為NA
D.5.6g鐵與足量稀硫酸反應失去電子數為0.3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】裝置Ⅰ、Ⅱ、Ⅲ是常用的三種制備氣體的裝置。裝置B、C、D、E、G、H是用于制取氯氣并進行漂白性質驗證的裝置。請根據裝置和所給的試劑回答下列問題:


實驗室提供的藥品有:銅片、高錳酸鉀、 二氧化錳、熟石灰、濃鹽酸、過氧化氫、稀硝酸、濃硝酸、氯化銨。
(1)根據提供藥品和裝置Ⅰ、Ⅱ、Ⅲ完成下列有關問題:
①實驗室制備氧氣,可選用的裝置是_________(填序號)。實驗室制氨氣所選試為__________。
②實驗室制備NO氣體的離子方程式為_____________________收集NO氣體可采用的方法是______________法。
③檢驗Ⅲ裝置氣密性的過程是___________________________________________。
(2)現用提供的制備裝置和裝置B、C、D、E、G、H來完成實驗室制備純凈氯氣并進行氯氣性質的驗證實驗。
①常溫下,高錳酸鉀和濃鹽酸可以發生反應生成Cl2和可溶性MnCl2,該反應氧化劑的化學式為________________,氧化產物的化學式為_________________,反應的離子方程式為___________________________________。
②制備純凈氯氣并驗證能起漂白作用的是次氯酸而不是氯氣,從左到右儀器的連接順序為a→d→e→_____________________________________________________→f。
③裝置D中發生反應的離子方程式為______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com