
已知下列兩個反應:①Fe+H2SO4(稀)=FeSO4+H2↑;
②Cu+2H2SO4(濃)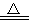 CuSO4+SO2↑+2H2O。試回答下列問題:
CuSO4+SO2↑+2H2O。試回答下列問題:
(1)反應①中 元素被還原,反應②中 元素被還原。(填元素符號)
(2 )反應②中生成32g SO2氣體時,消耗H2SO4的物質的量是 mol,其中有 g H2SO4作為氧化劑被還原。
)反應②中生成32g SO2氣體時,消耗H2SO4的物質的量是 mol,其中有 g H2SO4作為氧化劑被還原。
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:填空題
化學反應原理在生產和生 活中有廣泛的應用。
活中有廣泛的應用。
Ⅰ.NO2與SO2都是形成酸雨的主 要物質。在一定條件下,兩者能發生反應:
要物質。在一定條件下,兩者能發生反應:
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
(1)在一定條件下,將等物質的量的NO2、SO2氣體置于體積固定的密閉容器中發生反應,下列能說明反應已經達到平衡狀態的是
a.v(NO2)生成=v(SO2)消耗
b.混合氣體的總壓強不再改變
c.容器內氣體顏色不再改變
d.容器內氣體平均相對分子質量不再改變
(2)科學家正在研究利用催化技術將NO2和CO轉變成無害的CO2和N2,反應的化學方程式:
2NO2(g)+4CO(g)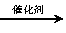 4CO2(g)+N2(g)+Q(Q>0)
4CO2(g)+N2(g)+Q(Q>0)
若在密閉容器中充入NO2和CO,下列措施能提高NO2轉化率的是 。
A.選用高效催化劑 B.充入NO2 C.降低溫度 D.加壓
Ⅱ.(1)17℃、1.01×105Pa,在2L密閉容器NO2和N2O4的混合氣體達到平衡時,NO2的物質的量為0.2mol,N2O4的體積分數為6/11。計算該條件下反應2NO2(g) N2O4(g)的平衡常數K= 。若此時向容器中再充入0.1mol NO2和0.12mol N2O4,原化學平衡 移動(填“正向”、“逆向”或“不”)。
N2O4(g)的平衡常數K= 。若此時向容器中再充入0.1mol NO2和0.12mol N2O4,原化學平衡 移動(填“正向”、“逆向”或“不”)。
(2)現用一定量的Cu與足量的濃HNO3反應,制得2.20L(已折算到標準狀況)已達到平衡的NO2 和N2O4的混合氣體,理論上至少需消耗Cu g(保留兩位小數)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高二12月月考化學試卷(解析版) 題型:選擇題
生產液晶顯示器的過程中使用的化學清洗劑NF3是一種溫室氣體,其儲存能量的能力是CO2的的12000~20000倍,在大氣中的壽命可長達740年之久,以下是幾種化學鍵的鍵能:
化學鍵 | N≡N | F-F | N-F |
鍵能/KJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列說法中正確的是
A.過程N2(g)→2N(g)放出能量
B.過程N(g)+3F(g)→NF3(g)放出能量
C.反應N2(g)+3F2(g)→2NF3(g)的△H>0
D.NF3吸收能量后如果沒有化學鍵的斷裂與生成,仍可能發生化學反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年青海省高二11月月考化學試卷(解析版) 題型:選擇題
下列敘述正確的是( )
A.增大反應物濃度能增大有效碰撞的幾率
B.增加壓強能增大反應物活化分子的百分數
C.增加反應物濃度能增大反應物活化分子的百分數
D.分解反應都是吸熱反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年青海省高二11月月考化學試卷(解析版) 題型:選擇題
2SO2(g)+O2(g) 2SO3(g)是制備硫酸的重要反應。下列敘述正確的是( )
2SO3(g)是制備硫酸的重要反應。下列敘述正確的是( )
A.催化劑V2O5不改變該反應的逆反應速率
B.增大反應體系的壓強,反應速率一定增大
C.該反應是放熱反應,降低溫度將縮短反應達到平衡的時間
D.在t1、t2時刻,SO3(g)的濃度分別是c1、c2,則時間間隔t1~t2內,SO3(g)生成的平均速率為v=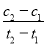
查看答案和解析>>
科目:高中化學 來源:2016-2017學年內蒙古高一期中化學卷(解析版) 題型:選擇題
已知反應SO2+2H2S=2H2O+3S,則氧化產物與還原產物的質量比為
A.1:1 B.2:1 C.3:1 D.1:2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年內蒙古高一期中化學卷(解析版) 題型:選擇題
將H2、 N2、O2三種氣體分別放入不同容 器,使它們溫度、密度相同,則其壓強(p)大小的關系符合
器,使它們溫度、密度相同,則其壓強(p)大小的關系符合
A.p(H2)>p(O2)>p(N2) B.p(O2)>P(N2)>p(H2)
C.p(H2)>P(N2)>p(O2) D.P(N2)>p(O2)>p(H2)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上段考二化學試卷(解析版) 題型:填空題
I、鐵及其化合物與生產、生活關系密切。
(1)右圖是實驗室研究海水對鐵閘不同部位腐蝕情況的剖面示意圖.
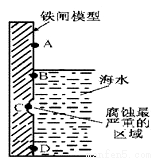
①該電化腐蝕稱為___________。
②圖中A、B、C、D四個區域,生成鐵銹最多的是___________ (填字母)。
(2)己知:Fe(s)+O2(g)=FeO(s)H=-272.0kJ•mol-1
C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g);△H=-221kJ•mol-1
則高爐煉鐵過程中FeO(s)+CO Fe(S)+CO2(g) △H=____________。
Fe(S)+CO2(g) △H=____________。
II、甲醇是一種重要的化工原料和新型燃料。下圖是甲醇燃料電池工作的示意圖,其中A、B、D均為石墨電極,C為銅電極.工作一段時間后,斷開K,此時A,B兩極上產生的氣體體積相同。
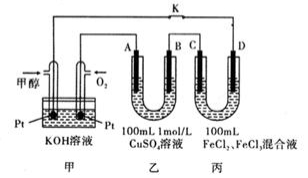
(1)甲中負極的電極反應式為_________________。
(2)乙中A極析出的氣體在標準狀況下的體積為_____________。
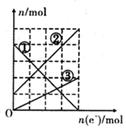
(3)丙裝置溶液中金屬陽離子的物質的量與轉移電子的物質的量變化關系右圖,則圖中②線表示的是_____________離子的變化;反應結束后,要使丙裝置中金屬陽離子恰好完全沉淀,需要_________________mL 5.0 mol•L-1 NaOH溶液。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣西省欽州港區高一上11月月考化學卷(解析版) 題型:填空題
現有下列十種物質:①液態HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶體 ⑥Ba(OH)2 ⑦紅褐 色的氫氧化鐵膠體 ⑧NH3·H2O ⑨空氣 ⑩Al2(SO4)3
色的氫氧化鐵膠體 ⑧NH3·H2O ⑨空氣 ⑩Al2(SO4)3
(1)上述十種物質中有兩種物質在水溶液中可發生反應,離子方程式為:H++OH-===H2O,該反應的化學方程式為_____________________。
(2)⑩在水中的電離方程式為___________________________。
(3)胃液中含有鹽酸,胃酸過多的人常有胃疼燒心的感覺,易吐酸水,服用適量的小蘇打(NaHCO3),能
治療胃酸過多,請寫出其反應的離子方程式:________________________;如果病人同時患胃潰瘍,為防胃壁穿孔,不能服用小蘇打,此時最好用含Al(OH)3的胃藥(如胃舒平),它與胃酸反應的離子方程式:________________________。
(4)寫出下列反應的離子方程式
向Ba(OH)2溶液中逐滴加入稀硫酸________________________。
向Ba(OH)2溶液中通入過量的CO2_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com