

分析 (1)①根據v=$\frac{△c}{△t}$計算出0~5min反應物A的反應速率;平衡常數與溫度有關,根據5min時的數據可以計算出該反應的平衡常數;
②根據圖2可知,該可逆反應達到平衡狀態后,升高溫度M的含量減少,則說明平衡向著逆向移動,據此判斷該反應的焓變;
(2)①反應物為肼和二氧化氮,反應產物為氮氣和水,根據化合價變化相等配平該反應;
②負極發生氧化反應、正極發生還原反應,根據化合價變化判斷通入氨氣電極;氨氣在堿性條件下失去電子生成肼,據此寫出該電極反應式;
③計算出二氧化碳、一水合氨的物質的量,判斷溶質組成,然后結合鹽的水解原理判斷各離子濃度大小;根據物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=$\frac{0.005mol}{0.1L}$=0.05mol/L.
解答 解:(1)①根據圖1可知,5min時A的物質的量變化為:4mol-2mol=2mol,則0~5min反應物A的反應速率為:v(A)=$\frac{\frac{2mol}{2L}}{5min}$=0.2mol/(L•min); 平衡時M的濃度為:$\frac{1mol}{2L}$=0.5mol/L,A的濃度為:$\frac{2mol}{2L}$=1mol/L,根據反應2A(g)?M(g)+2N(g)可知,平衡時N的濃度為1mol/L,則該反應的平衡常數為:K=$\frac{0.5×1}{1}$=0.5,
故答案為:0.2mol/(L•min); 0.5;
②從圖2可知,升高溫度后M的含量減少,說明化學平衡向著逆向移動,則逆向是吸熱反應,所以正反應為放熱反應,故△H<0,
故答案為:<;
(2)①發射火箭時肼(N2H4)為燃料,二氧化氮作氧化劑,兩者反應生成氮氣和氣態水,肼中N元素的化合價為-2價,反應后變為0價,化合價升高2價,至少升高4價;二氧化氮中氮元素的化合價為+4價,反應后變為0價,化合價降低4價,則肼和二氧化氮的計量數相等,再結合質量守恒定律配平后的化學方程式為:2N2H4+2NO2$\frac{\underline{\;點燃\;}}{\;}$3N2+4H2O,
故答案為:2N2H4+2NO2$\frac{\underline{\;點燃\;}}{\;}$3N2+4H2O;
②氨氣轉化成N2H4,化合價從-3變為-2,化合價升高被氧化,則通入氨氣的一極為負極;負極氨氣失去電子,在堿性條件下生成N2H4,負極的是電極反應式為:2NH3-2e-+2OH-=N2H4+2H2O,
故答案為:負極;2NH3-2e-+2OH-=N2H4+2H2O;
③標準狀況下112mL CO2的物質的量為:$\frac{0.112L}{22.4L/mol}$=0.005mol,100mL 0.1mo1/L的氨水中含有一水合氨的物質的量為0.01mol,二者恰好反應生成碳酸銨,溶液顯示堿性,則c(OH-)>c(H+),說明碳酸根離子的水解程度大于銨根離子,由于氫氧根來自水的電離和碳酸根離子的水解,則c(OH-)>c(HCO3-);由于水解程度減小,則c(NH4+)>c(CO32-),溶液中離子濃度大小為:c(NH4+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
根據溶液中的物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=$\frac{0.005mol}{0.1L}$=0.05mol/L,
故答案為:c(NH4+)>c(CO32-)>C(OH-)>c(HCO3-)>c(H+);0.05mol/L.
點評 本題考查了物質的量隨時間變化的曲線,題目難度中等,涉及化學平衡及其計算、電解原理、原電池及應用、化學方程式的書寫、離子濃度大小比較等知識,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用基礎知識的能力.


科目:高中化學 來源: 題型:解答題
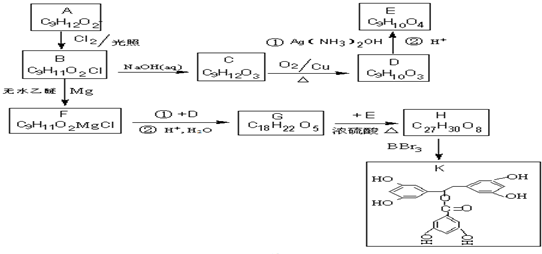
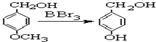
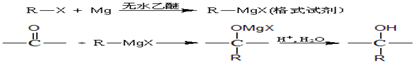
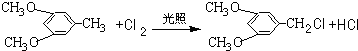 .
.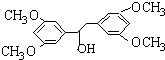 ;
;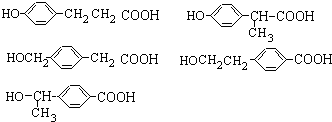 (任意3個);.
(任意3個);.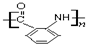 .(無機試劑任選.用流程圖表示:寫出反應物、產物及主要反應條件).
.(無機試劑任選.用流程圖表示:寫出反應物、產物及主要反應條件).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去溶液中Ag+加鹽酸鹽比硫酸鹽好 | |
| B. | 加入H20,溶解平衡不移動 | |
| C. | 用NaCl溶液代替蒸餾水洗滌AgCl,可以減少沉淀損失 | |
| D. | 反應2AgCl+Na2S═Ag2S+2NaCl 說明溶解度:AgCl>Ag2S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下pH=7的CH3COOH與CH3COONa的混合液中離子濃度大小順序為:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分別向2支試管中加入相同體積不同濃度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化劑對H2O2分解速率的影響 | |
| C. | 熱穩定性:HF>HC1>HBr>HI | |
| D. | 中和pH與體積均相同的鹽酸和醋酸溶液消耗NaOH的物質的量相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
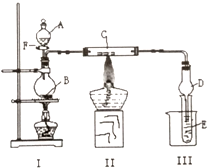 用如圖所示裝置進行有關實驗,拔掉分液漏斗上口玻璃塞,打開F,將A逐滴加入至B中.
用如圖所示裝置進行有關實驗,拔掉分液漏斗上口玻璃塞,打開F,將A逐滴加入至B中.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

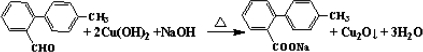 .
. 與
與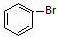 也可以發生類似反應①的反應,有機產物的結構簡式為:
也可以發生類似反應①的反應,有機產物的結構簡式為: .
.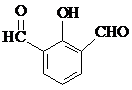 、
、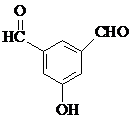 、
、
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 X、Y、Z、R、W均為周期表中前四周期的元素,其原子序數依次增大,其中只有W為第四周期元素.X與Y基態原子的成對電子數之比為2:3,未成對電子數之比為1:1,Z是元素周期表中s區元素,但有未成對電子,R的氫化物的沸點比其上周期同族元素氫化物的沸點低,W為金屬元素,Y與W形成的某種化合物與R的氫化物的濃溶液加熱時反應可用于實驗室制取R的氣態單質,回答下列問題:
X、Y、Z、R、W均為周期表中前四周期的元素,其原子序數依次增大,其中只有W為第四周期元素.X與Y基態原子的成對電子數之比為2:3,未成對電子數之比為1:1,Z是元素周期表中s區元素,但有未成對電子,R的氫化物的沸點比其上周期同族元素氫化物的沸點低,W為金屬元素,Y與W形成的某種化合物與R的氫化物的濃溶液加熱時反應可用于實驗室制取R的氣態單質,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;Z的電子式是
;Z的電子式是 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com