
【題目】實驗室制備硝基苯的主要步驟如下:
①配制一定比例的濃H2SO4與濃HNO3的混合酸,加入反應器中;
②向室溫下的混合酸中逐滴加入一定量的苯,充分振蕩,混合均勻;
③在50~60℃下發生反應,直至反應結束;
④除去混合酸后,粗產品依次用蒸餾水和5% NaOH溶液洗滌,
最后再用蒸餾,水洗滌;
⑤將用無水CaCl2干燥后的粗硝基苯進行蒸餾,得到純凈硝基苯.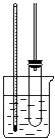
請填寫下列空白:
(1)配制一定比例濃H2SO4與濃HNO3混合酸時,如何混合? .
(2)步驟③中,為了使反應在50~60℃下進行,常用的方法是;
(3)裝置中常在試管上連接玻璃管,作用是什么? .
(4)步驟④中洗滌、分離粗硝基苯應使用的儀器是 .
(5)步驟④中粗產品用5% NaOH溶液洗滌的目的是 .
【答案】
(1)把濃硫酸慢慢注入濃硝酸中并不斷攪拌(或混合放出大量的熱,將密度大的注入密度下的溶液中,并不斷攪拌)
(2)水浴加熱
(3)冷凝兼回流揮發的苯和濃硝酸
(4)分液漏斗
(5)洗去粗產品中的酸性雜質
【解析】解:(1.)類比濃硫酸的稀釋可知,配制一定比例濃H2SO4與濃HNO3混合酸的方法為:把濃硫酸慢慢注入濃硝酸中并不斷攪拌,所以答案是:把濃硫酸慢慢注入濃硝酸中并不斷攪拌(或混合放出大量的熱,將密度大的注入密度下的溶液中,并不斷攪拌);
(2.)在50℃~60℃下發生反應,溫度小于100℃,采取水浴加熱,使受熱均勻,便于控制溫度,所以答案是:水浴加熱;
(3.)苯與濃硝酸易揮發,長導管冷凝兼回流揮發的苯和濃硝酸,減少損失,所以答案是:冷凝兼回流揮發的苯和濃硝酸;
(4.)分離互不相溶的液體采用分液方法分離,分液操作使用的儀器是分液漏斗,所以答案是:分液漏斗;
(5.)氫氧化鈉溶液具有堿性,能中和未反應的酸,所以氫氧化鈉的作用是洗去粗產品中的酸性雜質,所以答案是:洗去粗產品中的酸性雜質.


科目:高中化學 來源: 題型:
【題目】將純水加熱至較高溫度,下列敘述正確的是( )
A.水的離子積變大、pH變小、呈酸性
B.水的離了積不變、pH不變、呈中性
C.水的離子積變小、pH變大、呈堿性
D.水的離子積變大、pH變小、呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酰氯(SO2Cl2)常作氯化劑或氯璜化劑,用于制作藥品、染料、表面活性劑等。有關物質的部分性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 其它性質 |
SO2Cl2 | -54.1 | 69.1 |
②易分解:SO2Cl2 SO2↑+Cl2↑ |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
實驗室用干燥而純凈的二氧化硫和氯氣合成硫酰氯,反應的化學方程式為SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=-97.3kJ/mol。裝置如圖所示(夾持儀器已省略),請回答有關問題:
SO2Cl2(l)△H=-97.3kJ/mol。裝置如圖所示(夾持儀器已省略),請回答有關問題:

(1)儀器B的作用是_____________________。
(2)若無裝置乙硫酰氯會發生水解,則硫酰氯水解反應的化學方程式為________________。
(3)寫出丁裝置中發生反應的化學反應方程式并標出電子的轉移__________________。
(4)為提高本實驗中硫酰氯的產率,在實驗操作中需要注意的事項有_________(填序號)
①先通冷凝水,再通氣 ②控制氣流速率,宜慢不宜快
③若三頸燒瓶發燙,可適當降溫 ④加熱三頸燒瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解獲得,該反應的化學方程式為________________________,此方法得到的產品中會混有硫酸。從分解產物中分離出硫酰氯的方法是___________________。
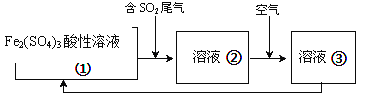
(6)工業上處理SO2廢氣的方法很多,例如可以用Fe2(SO4)3酸性溶液處理,其工藝流程如下溶液②轉化為溶液③發生反應的離子方程式為__________________________ ;
有的工廠用電解法處理含有SO2的尾氣,其裝置如下圖所示(電極材料均為惰性電極)。下列說法不正確的是_______
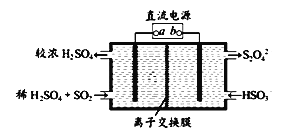
A.電極a連接的是電源的正極
B.若電路中轉移0.03mole-,則離子交換膜左側溶液中增加0.03mol離子
C.圖中的離子交換膜是陽離子交換膜
D.陰極的電極反應式為2HSO3-+2e-+2H+==S2O42-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E五種元素的原子序數依次增大,A原子無中子,B的單質在空氣中含量最多,C、D元素同主族且原子序數D為C的二倍,E元素的價電子排布式為(n﹣l)d10+6ns1 , 回答下列問題:
(1)元素B在周期表中的位置是 .
(2)D元素基態原子的外圍電子排布式為 .
(3)BC ![]() 的立體構型為 .
的立體構型為 .
(4)A元素與C元素形成兩種常見的化合物,其原子個數比分別為2:1和1:1,兩種化合物可以任意比互溶,原因是;其中一種化合物可在酸性條件下將KMnO4還原為Mn2+ , 寫出相關反應的離子方程式:
(5)將過量BA3氣體通入含E2+溶液中充分反應后生成的二價陽離子是(填離子符號),Imol該離子中含σ鍵為mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~G各物質間的關系如圖,其中B為可使帶火星木條復燃的氣態單質、D為黃綠色氣態單質。
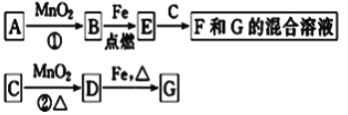
請回答下列問題:
(1)物質B和D分別為__________________________
(2)MnO2在反應①和②中的作用分別是______________________________
(3)新配制的F溶液應加入_____以防止其轉化為G.檢驗G溶液中陽離子的常用試劑是________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A是一元羧酸,由C,H,O元素組成,質量分數:C%40%;H 6.67%;取0.60g A配成溶液,用含0.01mol NaOH 的溶液能恰好完全中和.
(1)A的最簡式為;最簡式量為 .
(2)A的相對分子質量為;分子式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在催化劑作用下,用乙醇制乙烯,乙醇轉化率和乙烯選擇性(生成乙烯的物質的量與乙醇轉化的物質的量的比值)隨溫度、乙烯進料量(單位: ![]() )的關系如圖所示(保持其他條件相同)。
)的關系如圖所示(保持其他條件相同)。
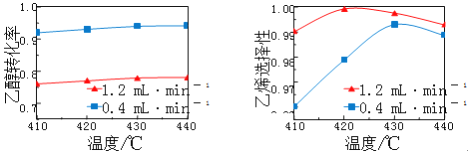
在410~440℃溫度范圍內,下列說法不正確的是
A. 當乙醇進料量一定,隨乙醇轉化率增大,乙烯選擇性升高
B. 當乙醇進料量一定,隨溫度的升高,乙烯選擇性不一定增大
C. 當溫度一定,隨乙醇進料量增大,乙醇轉化率減小
D. 當溫度一定,隨乙醇進料量增大,乙烯選擇性增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫度下,體積均為1L的兩個恒容密閉容器中發生可逆反應:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.6kJ/mol.測得數據如表
2NH3(g) △H=-92.6kJ/mol.測得數據如表
容器編號 | 起始時各物質物質的量/mol | 達到平衡時體系能量的變化 | ||
N2 | H2 | NH3 | ||
(1) | 2 | 3 | 0 | 27.78kJ |
(2) | 1.6 | 1.8 | 0.8 | Q |
下列敘述不正確的是
A.容器(1)(2)反應達平衡時壓強相等
B.容器(2)中反應開始時v(正)>v(逆)
C.容器(2)中反應達平衡時,吸收的熱量Q為9.26kJ
D.若條件為“絕熱恒容”,容器(1)中反應達平衡時n(NH3)<0.6mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用括號中注明的方法分離下列各組混合物,其中不正確的是( )
A. 汽油和煤油(蒸餾) B. 食鹽中的沙子(溶解過濾)
C. 氯化鈉和水(過濾) D. 花生油和水(分液)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com