
| A. | 與足量酸反應:離子方程式相同 | |
| B. | 熱穩定性:Na2CO3<NaHCO3 | |
| C. | 常溫下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物質的量與足量酸反應產生CO2的質量:Na2CO3<NaHCO3 |
分析 A.Na2CO3與足量酸反應為碳酸根與氫離子反應生成二氧化碳和水,而NaHCO3與足量酸反應為碳酸氫根與氫離子反應生成二氧化碳和水;
B.碳酸氫鈉受熱易分解,而碳酸鈉較穩定;
C.相同條件下,碳酸氫鈉的溶解度小;
D.利用關系式Na2CO3~CO2,NaHCO3~CO2來分析生成二氧化碳的質量大小.
解答 解:A.Na2CO3與足量酸反應為碳酸根與氫離子反應生成二氧化碳和水,反應的離子方程式為:CO32-+2H+=H2O+CO2↑,而NaHCO3與足量酸反應為碳酸氫根與氫離子反應生成二氧化碳和水,反應的離子方程式為:HCO3-+H+=+H2O+CO2↑,兩個反應的離子方程式不同,故A錯誤;
B.碳酸氫鈉受熱易分解,不穩定,則熱穩定性為:Na2CO3>NaHCO3,故B錯誤;
C.Na2CO3和NaHCO3在相同條件下,碳酸氫鈉的溶解度小,則在水中的溶解度大小為:Na2CO3>NaHCO3,故C正確;
D.Na2CO3和NaHCO3的物質的量相等,根據關系式Na2CO3~CO2、NaHCO3~CO2可知,產生的CO2的物質的量相等,則產生CO2的質量:Na2CO3=NaHCO3,故D錯誤;
故選C.
點評 本題考查碳酸鈉和碳酸氫鈉的性質,題目難度不大,涉及溶解度、穩定性、與酸的反應等知識,明確碳酸鈉、碳酸氫鈉的性質為解答關鍵,試題有利于提高學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
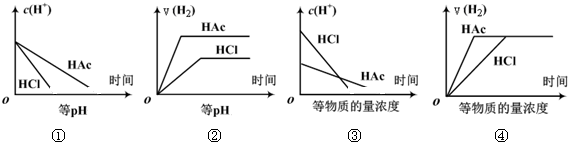
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 常溫下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH時,溶液的pH與所加NaOH溶液體積的關系如圖所示(不考慮揮發).下列說法正確的是( )
常溫下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH時,溶液的pH與所加NaOH溶液體積的關系如圖所示(不考慮揮發).下列說法正確的是( )| A. | 點a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 點b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 點c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 點d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X溶液 | 固體Y |  |
| A | 濃硫酸 | 銅粉 | |
| B | 濃氨水 | CaO | |
| C | 稀鹽酸 | 石灰石 | |
| D | 濃鹽酸 | 高錳酸鉀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
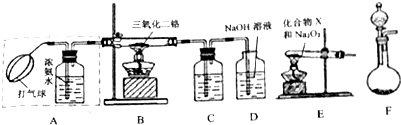
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
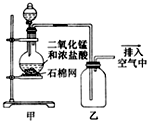
| A. | 該裝置圖中至少存在兩處明顯錯誤 | |
| B. | 燒瓶中的MnO2可換成KMnO4 | |
| C. | 在乙后連一盛有飽和食鹽水的燒杯可進行尾氣處理 | |
| D. | 在集氣瓶的導管口處放一片濕潤的淀粉碘化鉀試紙可以證明是否有氯氣逸出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com