
| 時間(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
| 0 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
分析 在前2min內,各物質的濃度的變化量之比(1-0.8):(3-2.6):(0.4-0)=1:2:2,則方程式為A (g)+2B(g)?2C(g),
(1)A物質的化學反應速率v(A)=$\frac{△c}{t}$,代入數據進行計算即可;
(2)影響化學反應速率的因素有:使用催化劑、改變溫度、濃度、改變物質的表面積等;
(3)求出第4min時各物質的濃度,根據平衡常數計算公式計算即可;
(4)根據Qc=$\frac{c{\;}^{2}(C)}{c(A)•{c}^{2}(B)}$,計算第9min時Qc的值,與K比較;
解答 解:在前2min內,各物質的濃度的變化量之比(1-0.8):(3-2.6):(0.4-0)=1:2:2,則方程式為A (g)+2B(g)?2C(g),
(1)第2min到第4min內A物質的化學反應速率v(A)=$\frac{△c}{t}$=$\frac{\frac{(0.8-0.4)mol}{2L}}{2min}$=0.1mol/(l•min),
故答案為:0.1;
(2)①在第0~2min內,A的物質的量減小了0.2mol,在2~4min內A的物質的量在原基礎上減小了0.4mol,化學反應速率加快了,可以是使用催化劑或升高溫度,
故答案為:使用催化劑、升高溫度;
②第6min 到第8min,作為反應物,濃度應該是減小的趨勢,但是B的物質的量從1.8mol增加到了2.0mol,而A在減小,C在增大,所以可知一定是加入了B物質,
故答案為:增加B的濃度;
(3)反應在第4min建立平衡,c(A)=$\frac{0.4mol}{2L}$=0.2mol/L,c(B)=$\frac{1.8mol}{2L}$=0.9mol/L,c(C)=$\frac{1.2mol}{2L}$=0.6mol/L,
則K=$\frac{c{\;}^{2}(C)}{c(A)•{c}^{2}(B)}$=$\frac{0.{6}^{2}}{0.2×0.{9}^{2}}$=2.22;
故答案為:2.22;
(4)Qc=$\frac{c{\;}^{2}(C)}{c(A)•{c}^{2}(B)}$=$\frac{({\frac{0.3}{2})}^{2}}{(\frac{0.05}{2})•(\frac{1.9}{2})^{2}}$=0.997<K=2.22,則反應未達到平衡狀態;
故答案為:否,因為Qc<K.
點評 本題主要考查了影響化學反應速率的因素和有關反應速率的計算、化學平衡常數的定義以及計算等,題目難度中等,題目綜合性較強,熟練掌握基礎知識是解決此類題是關鍵.


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | 石灰石.高嶺石.石英和水晶的主要成份都是硅酸鹽 | |
| B. | 濃硫酸具有吸水性.脫水性,還可以做氧化劑 | |
| C. | 過量鐵粉加入CuCl2溶液中,充分反應后溶液中的陽離子主要是Fe3+ | |
| D. | 硅是應用廣泛的半導體材料,常溫下易與氧氣、氯氣、硫酸等物質反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
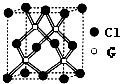 A、B、C、D、E、F、G為原子序數依次增大的前四周期元素.A、F原子的最外層電子數均等于其周期序數.F原子的電子層數是A的3倍; B原子核外電子分處3個不同能級.且每個能級上排布的電子數相同;A與C形成的最簡單分子為三角錐形;D原子p軌道上成對電子數等于未成對電子數;E原子核外每個原子軌道上的電子都已成對.E與F同周期;G的原子序數等于A、C、D、F 四種元素原子序數之和.
A、B、C、D、E、F、G為原子序數依次增大的前四周期元素.A、F原子的最外層電子數均等于其周期序數.F原子的電子層數是A的3倍; B原子核外電子分處3個不同能級.且每個能級上排布的電子數相同;A與C形成的最簡單分子為三角錐形;D原子p軌道上成對電子數等于未成對電子數;E原子核外每個原子軌道上的電子都已成對.E與F同周期;G的原子序數等于A、C、D、F 四種元素原子序數之和. ;回答E與F原子的第一電離能的大小關系怎樣,原因是Mg原子3s能級為全滿穩定結構,能量較低;
;回答E與F原子的第一電離能的大小關系怎樣,原因是Mg原子3s能級為全滿穩定結構,能量較低;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3可以做油漆的顏料 | B. | Al2O3可用作耐火材料 | ||
| C. | 王水可以雕刻玻璃 | D. | 赤鐵礦可用作煉鐵的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用鉑作催化劑 | B. | 降低溫度 | ||
| C. | 縮小體積增大壓強 | D. | 增大接觸面積 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150mL 1mol•L-1 氯化鈉溶液 | B. | 75mL 1mol•L-1 氯化鈣溶液 | ||
| C. | 150mL 3mol•L-1 氯化鉀溶液 | D. | 75mL 2mol•L-1 氯化鋇溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
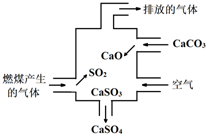
| A. | 使用此裝置可減少導致酸雨的氣體形成 | |
| B. | 用酸性高錳酸鉀溶液檢驗廢氣處理是否達標 | |
| C. | 整個過程的總反應可表示為:2SO2+2CaCO3+O2=2CaSO4+2CO2 | |
| D. | 排放的氣體是純凈物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
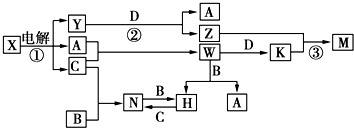
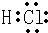 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com