
| 催化劑 |
| 高溫 |
A.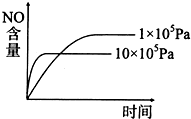 |
B.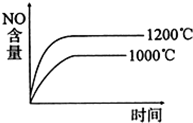 |
| C.NO難溶于水,可以用排水法收集 |
| D.當生成標準狀況下3.36L的氧氣時,該反應轉移0.6mole- |


 互動英語系列答案
互動英語系列答案 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案 黃岡海淀全程培優測試卷系列答案
黃岡海淀全程培優測試卷系列答案科目:高中化學 來源: 題型:
 N2O4(g)達到平衡.
N2O4(g)達到平衡. N2O4(g)的平衡常數K.
N2O4(g)的平衡常數K.查看答案和解析>>
科目:高中化學 來源: 題型:
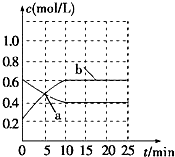 (2012?泉州二模)已知:2NO2(g)?N2O4(g)△H<0.現將NO2和N2O4的混合氣體通入恒溫密閉容器中,反應體系中物質濃度隨時間的變化關系如圖所示.下列說法正確的是( )
(2012?泉州二模)已知:2NO2(g)?N2O4(g)△H<0.現將NO2和N2O4的混合氣體通入恒溫密閉容器中,反應體系中物質濃度隨時間的變化關系如圖所示.下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 聯氨(N2H4)及其衍生物是重要的火箭燃料,N2H4與N2O4反應能放出大量的熱.
聯氨(N2H4)及其衍生物是重要的火箭燃料,N2H4與N2O4反應能放出大量的熱.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com