
【題目】高鐵酸鉀是綠色、環(huán)保型水處理劑,也是高能電池的電極材料。工業(yè)上利用硫酸亞鐵為原料,通過鐵黃(FeOOH)制備高鐵酸鉀,可降低生產(chǎn)成本且產(chǎn)品質量優(yōu)。工藝流程如下:

回答下列問題:
(1)有同學認為上述流程可以與氯堿工業(yè)聯(lián)合。寫出電解飽和食鹽水制取次氯酸鈉的化學方程式______________。
(2)制備鐵黃的離子方程式為_______________。實驗測得反應溶液的pH、溫度對鐵黃產(chǎn)率的影響如圖所示。反應溫度宜選擇_________;pH大于4.5時鐵黃產(chǎn)率逐漸降低的主要原因可能是_______________。

(3)用高鐵酸鉀作水處理劑除了可以對水體進行殺菌消毒之外,其還原產(chǎn)物氫氧化鐵膠體還能吸附水中懸浮雜質,請寫出用高鐵酸鉀除去水體中CN﹣的離子方程式______。
(4)已知:常溫下,Ksp[Fe(OH)3]=4.0×10﹣38。高鐵酸鉀的凈水能力與廢水的pH有關,當溶液pH=2時,廢水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,鐵元素總利用率為75%。利用1L 2molL﹣1FeSO4溶液能制備純度為90%的高鐵酸鉀________g。
【答案】 NaCl+H2O![]() NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性減弱,F(xiàn)e (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (膠體) +6CO32-+3N2↑+140H+ pH=2時, c(OH-) =10-12mol/L,根據(jù) KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性減弱,F(xiàn)e (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (膠體) +6CO32-+3N2↑+140H+ pH=2時, c(OH-) =10-12mol/L,根據(jù) KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
【解析】(1)電解飽和食鹽水制取次氯酸鈉的化學方程式為NaCl+H2O![]() NaClO+H2↑;(2)硫酸亞鐵與氧氣反應生成鐵黃(FeOOH)的反應中氧化劑為氧氣,還原劑為硫酸亞鐵,反應中鐵的化合價由+2合成+3價,O元素的化合價由0價變成-2價,根據(jù)得失電子守恒,氧化劑和還原劑的物質的量之比為
NaClO+H2↑;(2)硫酸亞鐵與氧氣反應生成鐵黃(FeOOH)的反應中氧化劑為氧氣,還原劑為硫酸亞鐵,反應中鐵的化合價由+2合成+3價,O元素的化合價由0價變成-2價,根據(jù)得失電子守恒,氧化劑和還原劑的物質的量之比為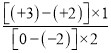 =
=![]() ,反應的離子方程式為12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根據(jù)圖像,40℃左右時,鐵黃產(chǎn)率較高;pH大于4.5時生成了氫氧化鐵,使得鐵黃產(chǎn)率降低;(3)高鐵酸鉀具有氧化性,可以將CN-氧化為氮氣和二氧化碳而除去,本身被還原為氫氧化鐵膠體,在堿性溶液中二氧化碳變成碳酸根離子,反應的方程式為10FeO42-+6CN-+22H2O=10Fe(OH)3(膠體)+6CO32-+3N2↑+14OH-;(4)pH=2時,c(OH-)=10-12mol/L,根據(jù)Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)=
,反應的離子方程式為12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根據(jù)圖像,40℃左右時,鐵黃產(chǎn)率較高;pH大于4.5時生成了氫氧化鐵,使得鐵黃產(chǎn)率降低;(3)高鐵酸鉀具有氧化性,可以將CN-氧化為氮氣和二氧化碳而除去,本身被還原為氫氧化鐵膠體,在堿性溶液中二氧化碳變成碳酸根離子,反應的方程式為10FeO42-+6CN-+22H2O=10Fe(OH)3(膠體)+6CO32-+3N2↑+14OH-;(4)pH=2時,c(OH-)=10-12mol/L,根據(jù)Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)= mol/L=0.04mol/L;
mol/L=0.04mol/L;
(5)1L 2mol·L-1FeSO4溶液中含有2mol FeSO4,根據(jù)鐵元素守恒,生成高鐵酸鉀的質量=2mol×75%×198g/mol÷90%=330g。


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】ClO2是一種優(yōu)良的消毒劑,濃度過高時易發(fā)生分解,常將其制備成NaClO2固體以便運輸和貯存。過氧化氫法制備NaClO2固體的實驗裝置如圖1所示。
已知:2NaClO2+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔點-59℃、沸點11℃;H2O2沸點150℃

請回答:
⑴儀器A的作用是_____;冰水浴冷卻的目的是_____(寫出兩種)。
⑵空氣流速過快或過慢,均降低NaClO2產(chǎn)率,試解釋其原因______。
(3)Cl-存在時會催化ClO2的生成。反應開始時在三頸燒瓶中加入少量鹽酸,ClO2的生成速率大大提高,并產(chǎn)生微量氯氣。該過程可能經(jīng)兩步反應完成,將其補充完整:①_____(用離子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4) H2O2濃度對反應速率有影響。通過圖2所示裝置將少量30% H2O2溶液濃縮至40%,B處應增加一個設備。該設備的作用是______,餾出物是_______。

(5)抽濾法分離NaClO2過程中,下列操作不正確的是_______
A.為防止濾紙被腐蝕,用玻璃纖維代替濾紙進行抽濾
B.先轉移溶液至漏斗,待溶液快流盡時再轉移沉淀
C.洗滌沉淀時,應使洗滌劑快速通過沉淀
D.抽濾完畢,斷開水泵與吸濾瓶間的橡皮管后,關閉水龍頭
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽是一類常見物質,下列物質可直接形成鹽的是( )
①金屬②堿性氧化物③堿 ④非金屬⑤酸性氧化物⑥酸
A. 只有①②③ B. 只有①④⑥ C. 只有②⑤⑥ D. 全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2(g)![]() 2NO(g)+O2(g)在恒容密閉容器中進行,達到平衡狀態(tài)的標志是
2NO(g)+O2(g)在恒容密閉容器中進行,達到平衡狀態(tài)的標志是
①單位時間內(nèi)生成n molO2的同時生成2n mol NO
②單位時間內(nèi)生成n molO2的同時生成2n mol NO2
③用NO2、NO、O2的物質的量濃度變化表示的反應速率之比為2:2:1的狀態(tài)
④混合氣體的顏色不再改變的狀態(tài)
⑤混合氣體的密度不再改變的狀態(tài)
⑥混合氣體的平均相對分子質量不再改變的狀態(tài).
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物廣泛存在于自然界中,試回答下列問題:
(1)某處碳循環(huán)如圖所示,CaCO3轉化為HCO3-的離子方程式為_____________。

(2)常溫常壓下,空氣中的CO2溶于水,達到平衡時,無機碳在濃液中以4種形式存在,其轉化關系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的電離及H2CO3的第二級電離,則溶液pH=_____。
(3)某化學小組為了測量湖水中無機碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,將吸收液用0.10mol/L鹽酸滴定,生成的V(CO2)隨V (鹽酸)變化關系如圖2所示,則吸收液中離子濃度由大到小的順序為______________(不用寫出H+),湖水中無機碳的濃度為_______mol/L。

(4)—定條件下,CO2和H2O可以轉化為CO和H2,通過反應:CO(g)+2H2(g) ![]() CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。
CH3OH(g)制備甲醇,若起始時在密閉容器中按物質的量之比1:2充入CO和H2,測得平衡時CO轉化率a (CO)隨T、P的變化關系如圖3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②該反應在195℃、P2條件下達到平衡后,c(H2)=0.5 mol/L ,則該反應的平衡常數(shù)為______。
③已知CH3OH和CO的燃燒熱分別725.8kJ/mol、283.0 kJ/mol,1mol液態(tài)水變成氣態(tài)水吸熱44.0kJ,寫出甲醇不完全燃燒生成一氧化碳和氣態(tài)水的熱化學方程式:_________________。
(5)用CH3OH和O2組合形成的質子交換膜燃料電池的結構示意圖4,則c電極的反應方程式為:_______________ 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高聚物F 和J的合成路線如下:

已知:
1 乙烯醇不穩(wěn)定,會迅速轉化為乙醛
2 CH2=CH2+1/2O2+CH3COOH-----CH2=CHOOCCH3+H2O
3 
(1)G中官能團的名稱是_________________。
(2)C的結構簡式是_____________________。
(3)芳香烴D的一氯代物只有兩種,則D的結構簡式是___________________。
(4)反應③的反應類型是___________________。
(5)反應②和⑤的化學方程式分別是:
反應②_________________;_______________
反應⑤_________________________________。
(6) E也可由A和2,4-己二烯為原料制備,請寫出該合成路線______________(無機試劑任選)。
E也可由A和2,4-己二烯為原料制備,請寫出該合成路線______________(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】—硝基甲苯是一種重要的工業(yè)原料,某化學學習小組設計如圖所示裝置制備一硝基甲苯(包括對硝基甲苯和鄰硝基甲苯)

實驗步驟如下:
①配制濃硫酸和濃硝酸的混合物(混酸);
②在三頸燒瓶里裝15 mL甲苯(密度為0.866 g·cm-3);
③裝好其他藥品,并組裝好儀器;
④向三頸燒瓶中加入混酸,并不斷攪拌;
⑤控制溫度,大約反應10分鐘至三頸燒瓶底有大量液體(淡黃色油狀)出現(xiàn);
⑥分離出一硝基甲苯,經(jīng)提純最終得到一硝基甲苯共15 g.
根據(jù)上述實驗,回答下列問題:
(1)本實驗的關鍵是控制溫度在30℃左右,如果溫度過高,則會產(chǎn)生__________等副產(chǎn)品(填物質名稱)
(2)簡述配制混酸的方法:____________________.
(3)A儀器名稱是__________,進水口是__________.
(4)寫出甲苯與混酸反應生成對硝基甲苯的化學方程式:___________________________.
(5)分離產(chǎn)品方案如下:

操作2的名稱是___________.經(jīng)測定,產(chǎn)品2的核磁共振氫譜中有5個峰,它的名稱為___________.
(6)本實驗中一硝基甲苯的產(chǎn)率為___________ (結果保留三位有效數(shù)字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室里做鈉跟水反應的實驗時,用到的儀器和藥品是:①試管夾、②鑷子、③小刀、④濾紙、⑤研缽、⑥燒杯、⑦坩堝、⑧石棉網(wǎng)、⑨玻璃片、⑩藥匙.
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是生命物質的重要組成元素之一,含氮物質與人類的生活密切相關。
(1)氮原子最外層電子排布式為:_________;氮離子![]() 核外有___種運動狀態(tài)不同的電子;N4分子的空間結構如圖:
核外有___種運動狀態(tài)不同的電子;N4分子的空間結構如圖:![]() ,它是一種_____分子。(填“極性”或“非極性”)
,它是一種_____分子。(填“極性”或“非極性”)
(2)氨氣是人工固氮的產(chǎn)物,它極易溶于水(![]() ),生成NH3 · H2O。請設計實驗證明NH3 · H2O是弱堿_______________________________。
),生成NH3 · H2O。請設計實驗證明NH3 · H2O是弱堿_______________________________。
(3)向100mL 0.1mol/L的鹽酸中通入0.02mol氨氣,充分吸收后測得溶液呈堿性。則該溶液中NH3 · H2O、![]() 、
、![]() 三種微粒的物質的量濃度大小關系為____________。
三種微粒的物質的量濃度大小關系為____________。
(4)銨鹽可用作氮肥,實驗室檢驗銨鹽中的![]() 時,可取少量銨鹽樣品于試管中,加入強堿濃溶液,加熱,若產(chǎn)生的氣體能使________________________________,說明有
時,可取少量銨鹽樣品于試管中,加入強堿濃溶液,加熱,若產(chǎn)生的氣體能使________________________________,說明有![]() 。
。
(5)NaN3可用于制造汽車安全氣囊,當汽車遇到撞擊時,NaN3能迅速分解產(chǎn)生Na和N2。請寫出該反應的化學方程式_______________________,每生成3mol N2時,轉移電子_____mol。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com