
分析 (1)發生沉淀的轉化生成氫氧化銅、硫酸鎂;
(2)Ksp小的先轉化為沉淀,最終溶液中c(Mg2+):c(Cu2+)=$\frac{Ksp[Mg(OH)_{2}]}{Ksp[Cu(OH)_{2}]}$;
(3)使Cu2+濃度降至原來的千分之一,c(Cu2+)=$\frac{0.2mol/L}{1000}$=2×10-4mol/L,結合Ksp[Cu(OH)2]=2×10-20計算.
解答 解:(1)向Mg(OH)2濁液中逐滴加入CuSO4溶液,發生沉淀的轉化,反應的離子方程式為Mg(OH)2+Cu2+=Mg2++Cu(OH)2,
故答案為:Mg(OH)2+Cu2+=Mg2++Cu(OH)2;
(2)由Ks可知,氫氧化銅更難溶,則向Mg2+、Cu2+均為0.1mol/l的溶液中逐滴加入過量NaOH溶液,先沉淀的離子為Cu2+,最終溶液中c(Mg2+):c(Cu2+)=$\frac{2×1{0}^{-11}}{2×1{0}^{-20}}$=1×109,
故答案為:Cu2+;1×109;
(3)使Cu2+濃度降至原來的千分之一,c(Cu2+)=$\frac{0.2mol/L}{1000}$=2×10-4mol/L,c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-4}}}$=10-8mol/L,則c(H+)=10-6mol/L,即pH=6,故答案為:6.
點評 本題考查難溶電解質的溶解平衡及計算,為高頻考點,把握沉淀轉化、溶度積的計算為解答的關鍵,側重分析與計算能力的考查,注意pH的調節及計算,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
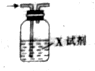 已知CO2通入澄清石灰水中,溶液先變渾濁,后又變澄清.用如圖裝置除去CO2氣體中的HCl,X試劑最合適的是( )
已知CO2通入澄清石灰水中,溶液先變渾濁,后又變澄清.用如圖裝置除去CO2氣體中的HCl,X試劑最合適的是( )| A. | NaOH溶液 | B. | 濃硫酸 | C. | Na2CO3溶液 | D. | NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
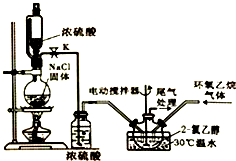 2-氯乙醇是一種重要的有機化工原料,受熱時易分解.通常是以適量的2-氯乙醇為溶劑,用氯化氫與環氧乙烷反應制得新的2-氯乙醇.制取反應裝置如圖所示.
2-氯乙醇是一種重要的有機化工原料,受熱時易分解.通常是以適量的2-氯乙醇為溶劑,用氯化氫與環氧乙烷反應制得新的2-氯乙醇.制取反應裝置如圖所示.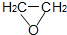 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名稱 | 相對分子質量 | 熔點(℃) | 沸點(℃) |
| 環氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
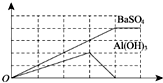 已知向溶液Q中滴加溶液P可生成兩種沉淀,所得沉淀量與所加入的P溶液的體積關系如圖所示,則Q、P分別為( )
已知向溶液Q中滴加溶液P可生成兩種沉淀,所得沉淀量與所加入的P溶液的體積關系如圖所示,則Q、P分別為( )| A. | Q為NH4Al(SO4)2,P為Ba(OH)2 | B. | Q為Ba(OH)2,P為明礬 | ||
| C. | Q為明礬,P為Ba(OH)2 | D. | Q為Ba(AlO2)2,P為硫酸鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗方案(只要求填寫選用試劑) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 實驗現象 | 針對方程式①②或③試管中先生成白色沉淀,后白色沉淀消失. 針對方程式④:試管中有白色沉淀. | 溶液由淺黃綠色變成橙黃色 |
| 有關反應的離子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 結論 | 金屬性:Mg>Al | 非金屬性:Cl>Br |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 24Mg32S 晶體中電子總數與中子總數之比為1:1 | |
| B. | CO2和PCl5分子中各原子最外層都滿足8 電子結構 | |
| C. | 若aXm+和bYn-兩種離子電子層結構相同,則a-b=n-m | |
| D. | 元素周期表中第4 列元素形成的化合物數目最多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com