
(15分)將水煤氣化轉化成合成氣,然后合成各種油品和石化產品是化工的極為重要的領域。除去水蒸氣后的水煤氣主要含H2、CO、CO2及少量的H2S、CH4,繼續除去H2S后,可采用催化或非催化轉化技術,將CH4轉化成CO,得到CO、CO2和H2的混合氣體,是理想的合成甲醇原料氣。
(1)制水煤氣的主要化學反應方程式為:C(s)+H2O(g) CO(g)+H2(g),此反應是吸熱反應。
①此反應的化學平衡常數表達式為 ;
②下列能增大碳的轉化率的措施是 ;
A.加入C(s) B.加入H2O(g) C.升高溫度 D.增大壓強
(2)將CH4轉化成CO,工業上常采用催化轉化技術,其反應原理為:
 CH4(g)+3/2O2(g)
CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
CH4(g)+3/2O2(g)
CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
①X在750℃時催化效率最高,能使正反應速率加快約3×105倍;
②Y在600℃時催化效率最高,能使正反應速率加快約3×105倍;
③Z在440℃時催化效率最高,能使逆反應速率加快約1×106倍;
已知根據上述信息,你認為在生產中應該選擇的適宜催化劑是 (填“X”或“Y”或“Z”),選擇的理由是 ;
(3)合成氣經壓縮升溫后進入甲醇合成塔,在催化劑作用下,進行甲醇合成,主要反應如下:
 2H2(g)+CO(g)
CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
2H2(g)+CO(g)
CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
|
物質 |
H2 |
CO |
CH3OH |
|
濃度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①該時間段內反應速率v(H2)= mol-1·L-1·min-1。
②比較此時正、逆反應速率的大小:
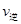 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生產過程中,合成氣要進行循環,其目的是 。
 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案 能考試全能100分系列答案
能考試全能100分系列答案科目:高中化學 來源:山東省實驗中學2012屆高三第一次診斷性考試化學試題 題型:022
將水煤氣化轉化成合成氣,然后合成各種油品和石化產品是化工的極為重要的領域.除去水蒸氣后的水煤氣主要含H2、CO、CO2及少量的H2S、CH4,繼續除去H2S后,可采用催化或非催化轉化技術,將CH4轉化成CO,得到CO、CO2和H2的混合氣體,是理想的合成甲醇原料氣.
(1)制水煤氣的主要化學反應方程式為:C(s)+H2O(g) CO(g)+H2(g),此反應是吸熱反應.
CO(g)+H2(g),此反應是吸熱反應.
①此反應的化學平衡常數表達式為________;
②下列能增大碳的轉化率的措施是________;
A.加入C(s)
B.加入H2O(g)
C.升高溫度
D.增大壓強
(2)將CH4轉化成CO,工業上常采用催化轉化技術,其反應原理為:
CH4(g)+3/2O2(g)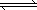 CO(g)+2H2O(g) ΔH=-519 kJ/mol.工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
CO(g)+2H2O(g) ΔH=-519 kJ/mol.工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
①X在750℃時催化效率最高,能使正反應速率加快約3×105倍;
②Y在600℃時催化效率最高,能使正反應速率加快約3×105倍;
③Z在440℃時催化效率最高,能使逆反應速率加快約1×106倍;
已知根據上述信息,你認為在生產中應該選擇的適宜催化劑是________(填“X”或“Y”或“Z”),選擇的理由是________;
(3)合成氣經壓縮升溫后進入甲醇合成塔,在催化劑作用下,進行甲醇合成,主要反應如下:
2H2(g)+CO(g)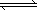 CH3OHg);ΔH=-90.8 kJ·mol-1,T℃下此反應的平衡常數為160.此溫度下,在密閉容器中開始只加入CO、H2,反應10 min后測得各組分的濃度如下:
CH3OHg);ΔH=-90.8 kJ·mol-1,T℃下此反應的平衡常數為160.此溫度下,在密閉容器中開始只加入CO、H2,反應10 min后測得各組分的濃度如下:
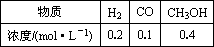
①該時間段內反應速率v(H2)=________mol-1·L-1·min-1.
②比較此時正、逆反應速率的大小:v正________v逆(填“>”、“<”或“=”)
(4)生產過程中,合成氣要進行循環,其目的是________.
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(15分)將水煤氣化轉化成合成氣,然后合成各種油品和石化產品是化工的極為重要的領域。除去水蒸氣后的水煤氣主要含H2、CO、CO2及少量的H2S、CH4,繼續除去H2S后,可采用催化或非催化轉化技術,將CH4轉化成CO,得到CO、CO2和H2的混合氣體,是理想的合成甲醇原料氣。
(1)制水煤氣的主要化學反應方程式為:C(s)+H2O(g) CO(g)+H2(g),此反應是吸熱反應。
①此反應的化學平衡常數表達式為 ;
②下列能增大碳的轉化率的措施是 ;
A.加入C(s) B.加入H2O(g) C.升高溫度 D.增大壓強
(2)將CH4轉化成CO,工業上常采用催化轉化技術,其反應原理為:
![]() CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
①X在750℃時催化效率最高,能使正反應速率加快約3×105倍;
②Y在600℃時催化效率最高,能使正反應速率加快約3×105倍;
③Z在440℃時催化效率最高,能使逆反應速率加快約1×106倍;
已知根據上述信息,你認為在生產中應該選擇的適宜催化劑是 (填“X”或“Y”或“Z”),選擇的理由是 ;
(3)合成氣經壓縮升溫后進入甲醇合成塔,在催化劑作用下,進行甲醇合成,主要反應如下:
![]() 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
| 物質 | H2 | CO | CH3OH |
| 濃度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
①該時間段內反應速率v(H2)= mol-1·L-1·min-1。
②比較此時正、逆反應速率的大小:![]()
![]() (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生產過程中,合成氣要進行循環,其目的是 。
查看答案和解析>>
科目:高中化學 來源:2012屆山東省實驗中學髙三第一次診斷性考試化學試卷 題型:填空題
(15分)將水煤氣化轉化成合成氣,然后合成各種油品和石化產品是化工的極為重要的領域。除去水蒸氣后的水煤氣主要含H2、CO、CO2及少量的H2S、CH4,繼續除去H2S后,可采用催化或非催化轉化技術,將CH4轉化成CO,得到CO、CO2和H2的混合氣體,是理想的合成甲醇原料氣。
(1)制水煤氣的主要化學反應方程式為:C(s)+H2O(g) CO(g)+H2(g),此反應是吸熱反應。
①此反應的化學平衡常數表達式為 ;
②下列能增大碳的轉化率的措施是 ;
| A.加入C(s) | B.加入H2O(g) | C.升高溫度 | D.增大壓強 |

 CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工業上要選擇合適的催化劑,分別對X、Y、Z三種催化劑進行如下實驗(其他條件相同) 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反應的平衡常數為160。此溫度下,在密閉容器中開始只加入CO、H2,反應10min后測得各組分的濃度如下:| 物質 | H2 | CO | CH3OH |
| 濃度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
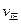
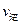 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com