
分析 (1)鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子;
(2)①根據電荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-濃度很小,在這里可以忽略不計),據此溶液中氫離子的濃度,再根據pH=-lgc(H+)計算;
②氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據得失電子守恒,則氯酸根離子的系數為1,Fe2+的系數為6,則鐵離子的系數也是6,氯離子的系數是1,根據電荷守恒,則氫離子的系數是6,水的系數是3;
(3)鐵離子的水解分為三步,且水解程度逐漸減弱,所以水解平衡常數逐漸減小;
控制條件使平衡正向移動,水解為吸熱反應,所以降溫平衡逆向移動;加水稀釋,則水解平衡也正向移動;加入氯化銨,氯化銨溶液為酸性,氫離子濃度增大,平衡逆向移動;加入碳酸氫鈉,則消耗氫離子,平衡正向移動;
從反應的離子方程式中可知,氫離子的濃度影響高濃度聚合氯化鐵的生成,所以關鍵步驟是調節溶液的pH.
解答 解:(1)鋼鐵設備中的Fe會與鐵離子反應生成亞鐵離子,離子方程式是:2Fe3++Fe=3Fe2+,
故答案為:2Fe3++Fe=3Fe2+;
(2)①根據電荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-濃度很小,在這里可以忽略不計),則c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,則溶液pH=-lg1.0×10-2=2,
故答案為:2;
②氯酸鈉氧化酸性的氯化亞鐵,則反應物中有氫離子參加,則生成物中有水生成,Cl元素的化合價從+5價降低到-1價,得到6個電子,而Fe元素的化合價從+2價升高到+3價,失去1個電子,根據得失電子守恒,則氯酸根離子的系數為1,Fe2+的系數為6,則鐵離子的系數也是6,氯離子的系數是1,根據電荷守恒,則氫離子的系數是6,水的系數是3,配平后離子方程式為:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案為:1;6;6H+;1;6;3H2O;
(3)鐵離子的水解分為三步,且水解程度逐漸減弱,所以水解平衡常數逐漸減小,則K1>K2>K3;
控制條件使平衡正向移動,使平衡正向移動,因為水解為吸熱反應,所以降溫,平衡逆向移動;加水稀釋,則水解平衡也正向移動;加入氯化銨,氯化銨溶液為酸性,氫離子濃度增大,平衡逆向移動;加入碳酸氫鈉,則消耗氫離子,所以氫離子濃度降低,平衡正向移動,故選bd;
從反應的離子方程式中可知,氫離子的濃度影響高濃度聚合氯化鐵的生成,所以關鍵步驟是調節溶液的pH,
故答案為:K1>K2>K3;bd;調節溶液的pH.
點評 本題考查鐵的化合物性質的應用、氧化還原反應方程式的配平、對圖象的分析能力、平衡移動影響因素等,需要學生具備扎實的基礎與靈活運用難度,題目難度中等.


 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:推斷題
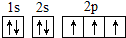 ,W的氣態氫化物穩定性比H2O(g)弱(填“強”或“弱”).
,W的氣態氫化物穩定性比H2O(g)弱(填“強”或“弱”).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋼鐵發生電化腐蝕的正極反應式:Fe-2e-═Fe2+ | |
| B. | 氫氧燃料電池的負極反應式:O2+2H2O+4e-═4OH- | |
| C. | 粗銅精煉時,與電源正極相連的是純銅,電極反應式為:Cu-2e-═Cu2+ | |
| D. | 電解飽和食鹽水時,陽極的電極反應式為:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度(mol•L-1) | NaOH物質的量濃度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗操作 | 實驗現象 |
| ①取10ml一定溶質質量分數的硫酸銅溶液,倒入50ml的燒杯里 ②取一塊鈉,用濾紙吸干表面煤油,再切取綠豆大小的一塊,投入溶液中 | 鈉浮在液面上,熔化成閃亮小球,鈉球游動,發出“嘶嘶”的聲響,析出藍色沉淀 |
| 實驗操作 | 實驗現象 | 結論 |
| 取燒杯中少許沉淀于試管中,再向其中加入過量的稀硫酸 | 沉淀全部溶解,溶液變藍色 | 說明沉淀中不含紅色的銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 列 周期 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉投入水中,浮在水面熔成小球,并在水面快速移動,得到的溶液顯堿性;Na+H2O═Na++OH-+H2↑ | |
| B. | 氫氣在氯氣中安靜的燃燒,發出淡藍色火焰,瓶口出現白霧;H2+Cl2═2HCl | |
| C. | 銅與稀硝酸反應:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com