解答:
解:(1)用醋酸羥基氧示蹤含氧18水占到總水量的一半,酯也一樣,說明酯化反應的歷程可能是首先乙酸分子中含有碳氧雙鍵打開發生加成反應,氧上連氫原子,碳上連乙氧基,生成
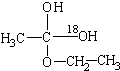
,連在同一碳上的兩個羥基不穩定,會失水發生消去反應,失水有兩種可能分別生成

,
故答案為:先加成反應生成

后消去失水,失水有兩種可能分別生成

(2分)
(2)化學平衡常數,是指在一定溫度下,可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,平衡常數只受溫度影響,120℃時,取CH
3COOH與C
2H
5OH投料比為1:1,產率65%,則K=
| C(CH3COOC2H5)C(H2O) |
| C(CH3COOH)C(C2H5OH) |
=
=3.45,
故答案為:
=3.45;
①乙醇(俗名酒精)分子式為C
2H
6O,其相對分子質量為46,摩爾質量為46g/mol,無水乙醇3600元/噸,則每摩乙醇
×46=0.1656 元,
乙酸分子式為C
2H
4O
2,其相對分子質量為60,摩爾質量為60g/mol,冰醋酸2900元/噸,則每摩乙酸
×60=0.174 元,
故答案為:0.1656;0.174;
②乙酸乙酯的制備反應是可逆反應,每摩乙醇
×46=0.1656 元,每摩乙酸
×60=0.174 元,不斷移走產物,使反應正向進行,補充反應物,從經濟實用角度應選擇乙醇過量,
故答案為:乙醇;
(3)液體乙酸乙醇沸點低,加入沸石(碎瓷片),可以通過孔隙凝聚蒸汽,使成為氣泡浮出,防止暴沸,如果加熱一段時間后發現忘記加瓷片,應該采取的正確操作是冷卻后補加,
故答案為:防暴沸; B;
(4)為防止酸液飛濺,應將密度大的液體加入到密度小的液體中,應將濃硫酸加入到乙醇中,防止硫酸溶解時放出大量的熱導致液體飛濺,
故答案為:先加入乙醇后加入硫酸,邊振蕩加滴加;
(5)通過分液漏斗中邊滴加乙酸和乙醇混和液邊加熱蒸餾,可以不斷增大乙酸和乙醇混和液的濃度,減小乙酸乙酯的濃度,有利于平衡向正反應方向移動,控制滴加乙酸和乙醇混和液的速度等于蒸餾速度目的保證乙醇量是乙酸量10倍以上,提高乙酸的轉化率,
故答案為:保證乙醇量是乙酸量10倍以上,提高乙酸的轉化率;
(6)

該反應為可逆反應,同時有副反應2C
2H
5OH
C
2H
5OC
2H
5+H
2O,所以反應物和生成物共存,蒸出的粗乙酸乙酯中主要有乙醚、乙酸、乙醇和水,飽和的Na
2CO
3溶液洗滌除去乙酸,碳酸鈉呈堿性,乙酸呈酸性,如果乙酸全去除,則溶液呈堿性,用PH試紙即可檢驗,
故答案為:乙醚、乙酸、乙醇和水;pH試紙檢驗不顯酸性;用飽和NaCl溶液洗滌除去殘留的Na
2CO
3溶液,如用水洗,導致產率降低,乙醇與水互溶,用飽和CaCl
2溶液直接洗滌可除去少量的乙醇;減少乙酸乙酯溶解; 除去少量的乙醇;

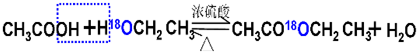

 ,連在同一碳上的兩個羥基不穩定,會失水發生消去反應,失水有兩種可能分別生成
,連在同一碳上的兩個羥基不穩定,會失水發生消去反應,失水有兩種可能分別生成 ,
, 后消去失水,失水有兩種可能分別生成
后消去失水,失水有兩種可能分別生成 (2分)
(2分) 該反應為可逆反應,同時有副反應2C2H5OH
該反應為可逆反應,同時有副反應2C2H5OH

 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案

