
| A. | 由CO2和O2組成的混合物中共有NA個分子,其中的氧原子數為2NA | |
| B. | 標準狀況下,14 g氮氣含有的核外電子數為5NA | |
| C. | 標準狀況下,5.6 L四氯化碳(CCl4)含有的分子數為0.25NA | |
| D. | NA個一氧化碳分子和0.5 mol 甲烷的質量比為7:4 |
分析 A、二氧化碳和氧氣中均含2個氧原子;
B、求出氮氣的物質的量,然后根據1mol氮氣中含14mol電子來分析;
C、標況下四氯化碳為液態;
D、NA個CO的物質的量為1mol,求出其質量.
解答 解:A、二氧化碳和氧氣中均含2個氧原子,故NA個CO2和O2組成的混合物中含2NA個氧原子,與兩者的比例無關,故A正確;
B、14g氮氣的物質的量n=$\frac{14g}{28g/mol}$=0.5mol,而1mol氮氣中含14mol電子,故0.5mol氮氣中含7mol電子即7NA個,故B錯誤;
C、標況下四氯化碳為液態,故不能根據氣體摩爾體積來計算其物質的量,故C錯誤;
D、NA個CO的物質的量為1mol,其質量m=nM=1mol×28g/mol=28g;0.5mol甲烷的質量m=nM=0.5mol×16g/mol=8g,故兩者的質量之比為28g:8g=7:2,故D錯誤;
故選A.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
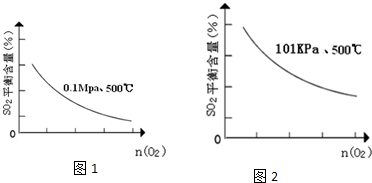
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用NaOH溶液滴定鹽酸,滴定前尖嘴下端有氣泡,滴定后氣泡消失,會使結果偏高 | |
| B. | 仰視量筒刻度量取一定量濃硫酸所配制的0.10 mol•L-1 H2SO4溶液的濃度結果偏低 | |
| C. | 焰色反應實驗中,鉑絲在蘸取待測溶液前應先用稀硫酸洗凈并灼燒至無色 | |
| D. | 要將溶解在CCl4中的碘分離出來,以用蒸餾法,因為碘易升華,先分離出來 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
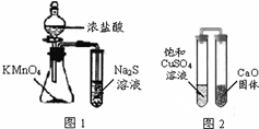
| A. | 下列有關實驗原理、操作或現象不正確的是圖1錐形瓶中滴入濃鹽酸后充滿黃綠色氣體,試管中出現淺黃色渾濁 | |
| B. | 圖2放置一段時間后,飽和CuSO4溶液中出現白色晶體 | |
| C. | 用玻璃棒蘸取某溶液做焰色反應實驗,火焰呈黃色說明該溶液中不含鉀元素 | |
| D. | 蒸餾時,將溫度計水銀球靠近蒸餾燒瓶支管口處 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
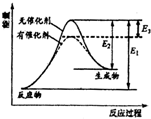 某反應的反應過程能量變化如圖所示,E1表示正反應的活化能,E2表示逆反應的活化能,下列說法正確的是( )
某反應的反應過程能量變化如圖所示,E1表示正反應的活化能,E2表示逆反應的活化能,下列說法正確的是( )| A. | 該反應為放熱反應 | B. | 該反應的焓變△H=E3 | ||
| C. | 催化劑不能降低反應的活化能 | D. | 該反應逆反應的焓變△H=E2-E1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體積為11.2L | B. | 摩爾質量是16g/mol | ||
| C. | 質量為32g | D. | 約含有6.02×1023個氧原子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com