
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是
A.50 g 34%H2O2溶液中含H-O鍵的數目為NA
B.180 g淀粉完全水解生成葡萄糖的分子數為NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的數目為0.1NA
D.反應5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2轉移電子的數目為NA
【答案】D
【解析】
A.50 g 34%H2O2溶液中,H2O2和H2O中都有H-O鍵,H2O2的物質的量為50g×34%÷34g/mol=0.5mol,H2O的物質的量為50g×(1-34%)÷18g/mol=1.83mol, H2O2中的H-O鍵的數目為NA,水中H-O鍵的數目約為3.66NA,A錯誤;
B.180g淀粉(C6H10O5)n的物質的量為![]() mol,根據(C6H10O5)n
mol,根據(C6H10O5)n![]() nC6H12O6,可生成C6H12O6的物質的量為
nC6H12O6,可生成C6H12O6的物質的量為![]() mol
mol ![]() 1.11mol,B錯誤;
1.11mol,B錯誤;
C.由于SiO32-水解,1 L 0.1 mol·L-1 K2SiO3溶液中含SiO32-的數目小于0.1NA,C錯誤;
D.反應中Cl元素的化合價由反應前的+3價(NaClO2)變為反應后的+4價(ClO2),每個Cl原子失去1個電子,故每生成1 mol ClO2轉移電子的數目為NA,D正確;
故選D。


科目:高中化學 來源: 題型:
【題目】中科院大連化學物理研究所的一項最新成果實現了甲烷高效生產乙烯,如圖所示,甲烷在催化作用下脫氫,在不同溫度下分別形成![]() 等自由基,在氣相中經自由基:CH2偶聯反應生成乙烯(該反應過程可逆)
等自由基,在氣相中經自由基:CH2偶聯反應生成乙烯(該反應過程可逆)

物質 | 燃燒熱/(kJmol-1) |
氫氣 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相關物質的燃燒熱如上表所示,寫出甲烷制備乙烯的熱化學方程式______________。
(2)現代石油化工采用Ag作催化劑,可實現乙烯與氧氣制備X(分子式為C2H4O,不含雙鍵)該反應符合最理想的原子經濟,則反應產物是____________(填結構簡式)
(3)在400℃時,向初始體積為1L的恒壓密閉反應,器中充入1 mol CH4,發生(1)中反應,測得平衡混合氣體中C2H4的體積分數為25.0%。則:

①在該溫度下,其平衡常數KC=____________。
②若向該反應器中通入高溫水蒸氣(不參加反應,高于400℃),則C2H4的產率____________。(填“增大”“減小”“不變”或“無法確定”),理由是_______________________________。
③若反應器的體積固定,不同壓強下可得變化如右圖所示,則壓強P1,P2的大小關系是____________。

(4)實際制備C2H4時,通常存在副反應2CH4(g)![]() C2H4(g)+2H2(g)。反應器和CH4起始量不變,不同溫度下C2H6和C2H4的體積分數與溫度的關系曲線如右圖所示。在溫度高于600℃時,有可能得到一種較多的雙碳有機副產物的名稱是____________。
C2H4(g)+2H2(g)。反應器和CH4起始量不變,不同溫度下C2H6和C2H4的體積分數與溫度的關系曲線如右圖所示。在溫度高于600℃時,有可能得到一種較多的雙碳有機副產物的名稱是____________。
(5)C2H4、C2H6常常作為燃料電池的原料,請寫出C2H4在NaOH溶液中做燃料電池的負極的電極反應方程式________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至過量。經測定,加入的NaOH的物質的量(mol)和所得沉淀的物質的量(mol)的關系如下圖所示。下列說法錯誤的( )
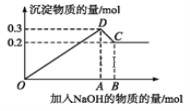
A.C點溶液中溶質為偏鋁酸鈉和氯化鈉
B.原溶液中Mg2+、Al3+的物質的量濃度之比為 2∶1
C.C點加入0.8mol NaOH
D.圖中線段OA∶AB=5∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢舊鍍鋅鐵皮(含Fe、Zn、Fe2O3、ZnO)制備納米Fe3O4及副產物ZnO的流程如下:
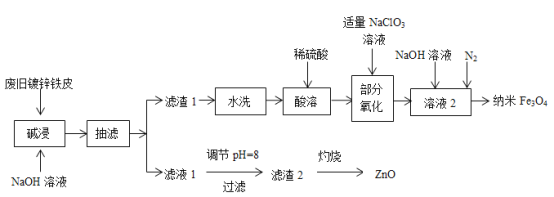
已知:Zn及其化合物的性質與Al及其化合物的性質相似,“濾液1”中鋅元素以ZnO22-形式存在。回答下列問題:
(1)實驗中需調節“濾液1”的pH約為8,pH過大或過小都不利的原因是_______________。
(2)“濾渣1”的主要成分是__________(填化學式,下同),“濾渣2”的主要成分是_______。
(3)“部分氧化”階段,ClO3-被還原為Cl-,該反應的離子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化學興趣小組用m1 g廢舊鍍鋅鐵皮(Fe元素的質量分數為w)制備納米Fe3O4,最終得到m2 g產品,則產率為__________(用含m1、m2和w的代數式表示)。
(6)用酸性高錳酸鉀溶液可測定產物Fe3O4中二價鐵含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4標準溶液進行滴定,發生反應:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判斷該反應到達滴定終點的現象是______________________________________________。
②滴定操作中,若滴定前裝有酸性KMnO4標準溶液的滴定管尖嘴部分無氣泡,而滴定結束后有氣泡,則測得的二價鐵含量__________(填“偏高”偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣污染越來越成為人們關注的問題,煙氣中的NOx必須脫除(即脫硝)之后才能排放。
(1)CO和H2可作為能源和化工原料,應用十分廣泛。 反應CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常數隨溫度的變化如表所示。
H2(g)+CO2(g)的平衡常數隨溫度的變化如表所示。
溫度/℃ | 400 | 500 | 830 | 1 000 |
平衡常數K | 10 | 9 | 1 | 0.6 |
①從上表可以推斷:此反應是__________(填“吸”或“放”)熱反應。
②在830 ℃下,若開始時向恒容密閉容器中充入CO與H2O均為1 mol,則達到平衡后CO的轉化率為________。
(2)在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列問題:
①CO的燃燒熱為 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化學鍵斷裂時分別需要吸收946 kJ、498 kJ的能量,則1 mol NO(g) 分子中化學鍵斷裂時需吸收的能量為_________kJ。
②寫出CO將NO2還原為單質反應的熱化學方程式為__________________________________________
(3)汽車排氣管上的催化轉化器,發生上述的CO將NO2還原為單質反應。在一定溫度下,將一定量的CO和NO2充入2L固定容積的容器中,回答以下問題:
①從反應開始到5min,生成了0.08mol N2,則5min內υ(CO)=___________________molL1min1。
②25min時,物質濃度變化如圖所示,則改變的條件可能是___________(填字母標號)。
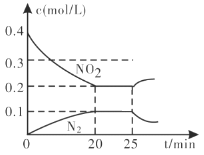
A.縮小容器體積 B.增加NO2的濃度 C.降低溫度 D.升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值,下列有關敘述正確的是( )
A.將78Na2O2與過量H2O反應轉移的電子數為NA
B.2molSO2與1molO2反應生成的SO3分子數為2NA
C.標準狀況下,2.24L SO3中所含原子數為0.4NA
D.1molCl2參加反應轉移電子數一定為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻礦是冶金、國防、化工等領域不可缺少的礦產資源,其中的鉻鐵礦是唯一可開采的鉻礦石。工業上常用鉻鐵礦(主要含Fe2O3、FeO和Cr2O3,還含有MgO、Al2O3、SiO2等雜質)為原料制備重鉻酸鉀和三氧化二鐵,其流程如圖所示。

已知常見離子開始生成沉淀和沉淀完全的pH如下表所示。

請回答下列問題:
(1)鉻鐵礦與熔融 NaOH 和 NaCIO3的反應是在坩堝中進行的,可用作此坩堝材料的是___________.
A.鎳 B.剛玉(Al2O3) C. 陶瓷 D.石英
(2)寫出鉻鐵礦中的Cr2O3與熔融 NaOH和NaCIO3反應的化學方程式:___。由于在該過程中鐵元素會大量轉變為NaFeO2,所以加水的作用為__________________(用離子方程式表示)。
(3)“濾渣 2”的主要成分為_________(填化學式)。
(4)利用化學平衡移動原理解釋調節pH2約至4.5的原因是;再向其中加入KC1固體,蒸發濃縮至液體表面有晶膜產生,冷卻結晶,過濾得到粗重鉻酸鉀晶體。為獲得高純度重鉻酸鉀晶體,可采取___________(填操作名稱)。
(5)調節pH3的范圍為__________
(6)已知鉻鐵礦中鐵、鉻元素的質量比為14:13.上述流程中鐵元素轉化為Fe2O3的利用率為60%,提取鉻元素的轉化率為90%,如果得到Fe2O3的質量為32t,則可以制備K2Cr2O7的質量為______t(結果保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.1 L由NaCl、MgCl2、BaCl2組成的混合溶液中,部分離子濃度大小如圖所示,下列對該溶液成分說法不正確的是( )
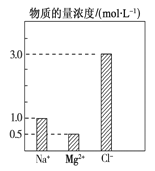
A. NaCl的物質的量為0.1mol
B. 該混合液中BaCl2的物質的量為0.05mol
C. 溶質MgCl2的質量為9.5 g
D. 將該混合液加水稀釋至體積為1 L,稀釋后溶液中的Na+物質的量的濃度為0.1mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中共十九大報告指出,加快水污染防治、實施流域環境和近岸海域綜合治理、環境污染的治理是化學工作者研究的重要課題,也是踐行“綠水青山就是金山銀山”的重要舉措。在適當的條件下,將CO2轉化為甲醇、甲醚等有機物,既可降低CO2造成的溫室效應對環境的影響,還可得到重要的有機產物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
則2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K時,某恒容密閉容器中存在如下反應:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,測得容器中不同時刻時各物質的濃度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,測得容器中不同時刻時各物質的濃度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
開始時 | a | b | 0 | 0 |
10 s時 | 3 | 0.5 | c | 1.5 |
①若反應開始到10s時間段內,v(H2)=____。
②若TK時,化學平衡常數K=15,則10s時v(正)___v(逆)(填“>”“<”或“=”),此時CO2的轉化率為____。
(3)一定條件下,向某恒容密閉容器中充入x mol CO2和ymolH2,發生的反應為CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。圖1中能表示該反應的平衡常數K與溫度T之間的變化關系曲線為___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。圖1中能表示該反應的平衡常數K與溫度T之間的變化關系曲線為___(填“a”或“b”)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com