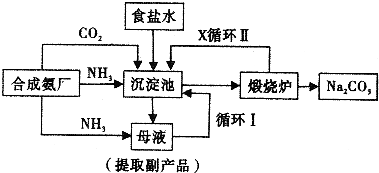
[化學選修2--化學與技術]1892年,比利時人索爾維以NaCl、CO2、H2O為原料生產Na2CO3,叫索爾維法.其主要步驟是:
(1)在NH3飽和的NaCl液中通入CO2制得的NaHCO3;
(2)再將NaHCO3焙燒制得純堿,CO2循環使用;
(3)析出小蘇打的母液中加入生石灰,NH2循環使用.
1940年,我國著名化學家侯德榜先生沖破了“索爾維法”技術封鎖,并加以改進,用NaCl固體代替生石灰;加入母液使NH4Cl晶體析出,生產出純堿和氯化銨.這便是舉世聞名的“侯氏制堿法”.
試回答:
(1)向母液通入氨氣的目的和作用是______.
(2)在氨飽和NaCl溶液中通入CO2的兩步反應方程式為______.
(3)不能在NaCl溶液中通入CO2制NaHCO3的原因是______.
(4)析出小蘇打的母液中加入生石灰的反應方程式是______.
(5)“侯氏制堿法”與“索爾維法”相比較其優點是______.
【答案】分析:(1)二氧化碳在水溶液中溶解度小,生成碳酸氫鈉少,不能析出晶體;
(2)氨化的飽和氯化銨溶液中通入過量二氧化碳,發生反應二氧化碳和氨水反應生成碳酸氫銨,碳酸氫銨和氯化鈉反應,由于碳酸氫鈉溶解度小,所以先生成碳酸氫鈉晶體析出;
(3)依據CO2在NaCl溶液中溶解度較小,生成NaHCO3太少不會結晶分析;
(4)析出小蘇打的母液中加入生石灰是為了生成強堿和銨鹽反應生成氨氣循環利用;
(5)分析比較兩種制備流程,結合反應生成產物比較異同,從副產物的主要作用和原料利用等分析比較;
解答:解:(1)二氧化碳在水溶液中溶解度小,生成碳酸氫鈉少,不能析出晶體;向母液通入氨氣的目的和作用是:增大二氧化碳的溶解度;
故答案為:增大二氧化碳的溶解度;
(2)氨化的飽和氯化銨溶液中通入過量二氧化碳,發生反應二氧化碳和氨水反應生成碳酸氫銨,碳酸氫銨和氯化鈉反應,由于碳酸氫鈉溶解度小,所以先生成碳酸氫鈉晶體析出;在氨飽和NaCl溶液中通入CO2的兩步反應方程式為:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
故答案為:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(3)不能在NaC1溶液中通入CO2制NaHCO3的原因是,CO2在NaCl溶液中溶解度較小,生成NaHCO3太少不會結晶;
故答案為:CO2在NaCl溶液中溶解度較小,生成NaHCO3太少不會結晶;
(4)析出小蘇打的母液中加入生石灰是為了生成強堿和銨鹽反應生成氨氣循環利用;反應的化學方程式為:CaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
故答案為:CaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
(5)索爾維法缺點:大量CaCl2用途不大,NaCl利用率只有70%,約有30%的NaCl留在母液中.
侯氏制堿法的優點:把合成氨和純堿兩種產品聯合生產,提高了食鹽利用率,縮短了生產流程,減少了對環境的污染,降低了純堿的成本.保留了氨堿法的優點,消除了它的缺點,使食鹽的利用率提高到96%;NH4Cl可做氮肥;可與合成氨廠聯合,使合成氨的原料氣CO轉化成CO2,減少無用的氯化鈣生成;
故答案為:使NH4Cl析出,可做氮肥;減少無用的CaCl2生成,原料NaCl充分利用;
點評:本題考查了純堿工業制備原理分析比較,反應實質的應用,試劑的作用,理解生產原理和過程的實質是交通工具,題目難度中等.



 閱讀快車系列答案
閱讀快車系列答案

 [化學選修2-化學與技術]我國氯堿工業迅速發展,產量已躍居世界首位,并培植了精細化工“產品樹”.
[化學選修2-化學與技術]我國氯堿工業迅速發展,產量已躍居世界首位,并培植了精細化工“產品樹”.