
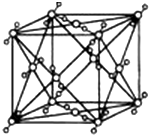
 已知A、B、C、D、E都是周期表中的前四周期的元素,它們的核電荷數A<B<C<D<E.其中B、D、E原子最外層電子層的P能級(軌道)上的電子處于半充滿狀態.通常情況下,A的一種氧化物分子為非極性分子,其晶胞結構如右圖所示.原子序數為31的元素鎵(Ga)與元素B形成的一種化合物是繼以C單質為代表的第一類半導體材料和GaE為代表的第二代半導體材料之后,在近10年迅速發展起來的第三代新型半導體材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它們的核電荷數A<B<C<D<E.其中B、D、E原子最外層電子層的P能級(軌道)上的電子處于半充滿狀態.通常情況下,A的一種氧化物分子為非極性分子,其晶胞結構如右圖所示.原子序數為31的元素鎵(Ga)與元素B形成的一種化合物是繼以C單質為代表的第一類半導體材料和GaE為代表的第二代半導體材料之后,在近10年迅速發展起來的第三代新型半導體材料.分析 A、B、C、D、E都是周期表中的前四周期的元素,它們的核電荷數A<B<C<D<E.其中B、D、E原子最外層電子層的P能級(軌道)上的電子處于半充滿狀態,外圍電子排布式為ns2np3,則B為N元素、D為P元素、E為As;通常情況下,A的一種氧化物分子為非極性分子,由其晶胞結構可知為CO2,A為碳元素;原子序數為31的元素鎵(Ga)與元素B形成的一種化合物是繼以C單質為代表的第一類半導體材料和GaE為代表的第二代半導體材料之后,可推知C為Si.
解答 解:A、B、C、D、E都是周期表中的前四周期的元素,它們的核電荷數A<B<C<D<E.其中B、D、E原子最外層電子層的P能級(軌道)上的電子處于半充滿狀態,外圍電子排布式為ns2np3,則B為N元素、D為P元素、E為As;通常情況下,A的一種氧化物分子為非極性分子,由其晶胞結構可知為CO2,A為碳元素;原子序數為31的元素鎵(Ga)與元素B形成的一種化合物是繼以C單質為代表的第一類半導體材料和GaE為代表的第二代半導體材料之后,可推知C為Si.
(1)Ga與Al同主族相鄰,Ga原子核外電子數為13+18=31,核外電子排布式為:1s22s22p63s23p63d104s24p1,故答案為:1s22s22p63s23p63d104s24p1;
(2)同周期隨原子序數增大,元素第一電離能呈增大趨勢,但N元素原子2p能級為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素的,同主族自上而下第一電離能增大,故第一電離能:N>C>Si,
故答案為:N>C>Si;
(3)B元素為N2,結構式為N≡N,分子中有2個π鍵,與其互為等電子體的物質的化學式可能為CO或CN-,
故答案為:2;CO或CN-;
(4)上述A的氧化物為CO2,為直線形結構,分子中C原子采取sp雜化,屬于分子晶體,其晶胞中微粒間的作用力為分子間作用力,
故答案為:sp;分子間作用力;
(5)AsH3分子與NH3分子構型相似,為三角錐形結構,由于NH3分子之間存在氫鍵,故AsH3的沸點比NH3的低,
故答案為:三角錐形;低;NH3分子之間存在氫鍵;
(6)向CuSO4溶液中逐滴加入NH3的水溶液,先生成Cu(OH)2藍色沉淀,后沉淀逐漸溶解得到深藍色的透明溶液,生成[Cu(NH3)4]2+,沉淀溶解的離子方程式:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案為:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
點評 本題是對物質結構與性質的考查,涉及結構性質物質關系、核外電子排布、電離能、化學鍵、等電子體、空間構型與雜化方式判斷、氫鍵、配合物等,是對學生綜合能力的考查,需要學生具備知識的基礎.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:填空題
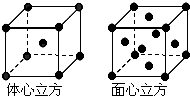 如下表是元素周期表中的前四周期,①~⑨為相應的元素,請從中選擇合適的元素回答問題
如下表是元素周期表中的前四周期,①~⑨為相應的元素,請從中選擇合適的元素回答問題 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 裝置 | 現象 | 結論及解釋 |
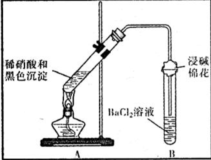 | ①A試管中黑色沉淀逐漸溶解 ②A試管上方出現紅棕色氣體 ③B試管中出現白色沉淀 | a.現象②說明褐色沉淀具有 還原性性. b.試管B中產生白色沉淀的總反應的離子方程式為 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | B | |
| C | D |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣主要成分之一.請回答:
已知X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣主要成分之一.請回答: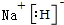
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
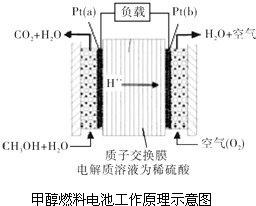 科學家預言,燃料電池將是21世紀獲得電能的重要途徑.近幾年開發的甲醇燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過.其工作原理的示意圖如圖所示:
科學家預言,燃料電池將是21世紀獲得電能的重要途徑.近幾年開發的甲醇燃料電池是采用鉑作電極催化劑,電池中的質子交換膜只允許質子和水分子通過.其工作原理的示意圖如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使它轉化為較穩定物質,便于保存和運輸 | |
| B. | 增強漂白和消毒作用 | |
| C. | 使轉化為較易溶于水的物質 | |
| D. | 增加氯的質量分數,有利于漂白、消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鄰-二溴苯只有一種 | |
| B. | 苯分子中所有原子在同一平面上 | |
| C. | 二甲苯沒有同分異構體 | |
| D. | 苯既能發生加成反應也能發生取代反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com