
等物質的量濃度、等體積的下列物質的溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3下列關系或者說法正確的是( )
⑤(NH4)2CO3下列關系或者說法正確的是( )
A.c(CO )的大小關系為②>⑤>③>④>①
)的大小關系為②>⑤>③>④>①
B.c(HCO )的大小關系為④>③>⑤>②>①
)的大小關系為④>③>⑤>②>①
C.將溶液蒸干、灼燒后只有①不能得到對應的固體物質
D.②③④⑤既能與鹽酸反應,又能與NaOH溶液反應
 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源:2016-2017學年江西省贛州市十四校高一上期中化學卷(解析版) 題型:實驗題
實驗室在加熱條件下H2還原CuO所得的紅色固體可能是Cu與Cu2O的混合物,已知Cu2O在酸性溶液中可發生自身氧化還原反應,生成Cu2+和單質銅。現有8g CuO被H2還原后,得到紅色固體6.8g。
(1)寫出H2還原CuO生成Cu2O的化學方程式 ;
(2)6.8 g上述混合物中含Cu與Cu2O的物質的量之比是 ;
(3)若將6.8 g上述混合物與足量的稀硫酸充分反應后過濾,可得到固 體 g
體 g
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省蘄春縣高二上學期期中化學試卷(解析版) 題型:填空題
T℃時,在2L恒容密閉容器中氣態物質X、Y、Z的物質的量隨時間變化的部分數據如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)寫出該反應的化學方程式_________________
(2)反應進行到10min,X的轉化率為___________,0~5min內Y的平均反應速率為___________
(3)計算T℃時該反應的平衡常數K=____________
(4)T℃下向該密閉容器中通入一定量的X、Y、Z,反應到某時刻測得X、Y、Z的物質的量分別為1.00mol、0.50mol、1.60mol,則此時正逆反應速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5時刻分別改變該反應的某一反應條件,得到X、Z的物質的量及反應速率與時間的關系如下圖A、B所示:
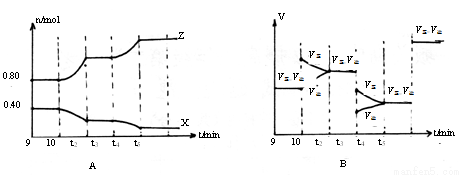
10min時改變的反應條件是_______________
②t3時刻改變的反應條件是_______________
③t5時刻改變的反應條件是 ,理由是___________________
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省蘄春縣高二上學期期中化學試卷(解析版) 題型:選擇題
一定溫度下,對可逆反應A(s)+2B(g) 3C(g)的下列敘述中,不能說明反應已達到平衡的是
3C(g)的下列敘述中,不能說明反應已達到平衡的是
A.C生成的速率與C分解的速率相等
B.單位時間內消耗a mol A,同時生成3a mol C
C.容器內的壓強不再變化
D.混合氣體的物質的量不再變化
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省高二上學期期中化學試卷(解析版) 題型:填空題
(1) 某溫度時,在10 L密閉容器中氣態物質X和Y反應生成氣態物質Z,它們的物質的量隨時間的變化下表中數據

①體系中發生反應的化學方程式是___________
②該反應在0~5 min時間內產物Z的平均反應速率:___________
③該反應達到平衡時反應物X的轉化率α等于___________
(2) 在密閉容器里,通入x mol H2(g)和y mol I2(g),發生反應:H2(g)+I2(g)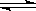 2HI(g) △H <0。改變下列條件,反應速率將如何改變?(選填“增大”“減小”或“不變”)
2HI(g) △H <0。改變下列條件,反應速率將如何改變?(選填“增大”“減小”或“不變”)
①升高溫度___________
②加入催化劑___________
③充入更多的H2 ___________
④保持容器中壓強不變,充入氖氣___________
⑤保持容器容積不變,通入氖氣___________
⑥保持壓強不變,充入2x mol H2(g)和2y mol I2(g)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省高二上學期期中化學試卷(解析版) 題型:選擇題
下列離子方程式中,屬于水解反應的是( )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HCO
HCO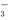 +H+
+H+
C.CO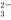 +H2O
+H2O HCO
HCO +OH-
+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省菏澤市高二上學期期中化學試卷(解析版) 題型:填空題
在100℃時,將0.200mol的四氧化二氮氣體充入2L抽空的密閉容器中,每隔一定時間對該容器內的物質進行分析,得到如下表格:
時間(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)mol | 0.200 | c1 | 0.10 | c3 | a | b |
c(NO2)mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
試填空:(1)該反應的化學方程式為_______________,
(2)達到平衡時四氧化二氮的轉化率為__________________。
(3)20s時四氧化二氮的濃度c1=_____________mol·L-1,
(4)在0~20s時間段內,二氧化氮的平均反應速率為_____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省菏澤市高二上學期期中化學試卷(解析版) 題型:選擇題
下列有關化學反應速率的敘述中,正確的是( )
A.100mL2mol/L的鹽酸與鋅反應時,加入適量的氯化鈉溶液,生成氫氣的速率不變
B.用鐵片和稀硫酸反應制取氫氣時,改用鐵片和濃硫酸可以加快產生氫氣的速率
C.汽車尾氣中的CO和NO可以緩慢反應生成N2和CO2,加入催化劑,不影響CO的轉化率
D.二氧化硫的催化氧化是一個放熱反應,升高溫度,平衡逆向移動,正反應速率減慢
查看答案和解析>>
科目:高中化學 來源:2016-2017學年內蒙古高二上學期期中化學試卷(解析版) 題型:選擇題
下列關系的表述中,正確的是( )
A.0.1mol· L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B.中和pH和體積都相同的鹽酸和醋酸,消耗NaOH的物質的量之比為1:1
C.pH=3的鹽酸和pH=3的FeCl3溶液中,由水電離出的c(H+)相等
D.0.1mol· L-1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com