
 SO3(g)+NO(g)
SO3(g)+NO(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1 SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。 SO3(g)+NO(g)。下列事實中不能說明該反應達到平衡狀態的是 (選填序號)。
SO3(g)+NO(g)。下列事實中不能說明該反應達到平衡狀態的是 (選填序號)。 CH3OH(g)。今在一容積可變的密閉容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡轉化率(α)與溫度(T)、壓強(P)的關系如圖所示:
CH3OH(g)。今在一容積可變的密閉容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡轉化率(α)與溫度(T)、壓強(P)的關系如圖所示:
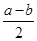 ②ad ③0.075mol/(L?min) 9
②ad ③0.075mol/(L?min) 9 2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g)
2SO3(g) ΔH=a kJ·mol-1、2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1,則根據蓋斯定律可知前者減去后者即得到反應2SO2(g)+2NO2(g)
2NO2(g) ΔH=b kJ·mol-1,則根據蓋斯定律可知前者減去后者即得到反應2SO2(g)+2NO2(g) 2SO3(g)+
2SO3(g)+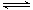 SO3(g)+NO(g) ΔH=
SO3(g)+NO(g) ΔH=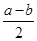 kJ·mol-1。
kJ·mol-1。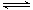 SO3(g)+NO(g)
SO3(g)+NO(g)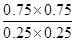 =9
=9

科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

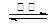 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①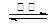 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②| A.Na2S溶液的pH比NaHS溶液pH小 |
| B.兩溶液中含有的離子種類不同 |
| C.兩溶液中滴入同體積同濃度的鹽酸,產生氣體速率相等 |
| D.兩溶液中加入NaOH固體,c(S2-)都增大 |
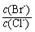 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】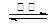 2CO(g)的ΔH =
2CO(g)的ΔH = 查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。| 溫度(K) CO2轉化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
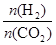 ],CO2的轉化率 (填“增大”“減小”或“不變”)。
],CO2的轉化率 (填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com