
【題目】短周期元素Q、R、T、W在元素周期表中位置如圖所示,其中T所處的周期序數與主族序數相等, 請回答下列問題:
(1)T的原子結構示意圖為 , R的最簡單氫化物的電子式為 , Q的1:1型氫化物中相對分子質量最小的分子是型分子(立體構型).
(2)元素的非金屬性為(原子的得電子能力):QW(填“強于”或“弱于”).
(3)W的單質與其最高價氧化物的水化物濃溶液共熱能發生反應,生成兩種物質,其中一種是氣體,反應的化學方程式為 .
(4)R有多種氧化物,其中氧化物甲的相對分子質量最小.在一定條件下,2L的甲氣體與0.5L的氧氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,所生成的R的含氧酸鹽的化學式是 .
【答案】
(1)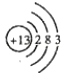 ;
;![]() ;直線
;直線
(2)弱于
(3)S+2H2SO4(濃) ![]() 3SO2+2H2O
3SO2+2H2O
(4)NaNO2
【解析】解:由短周期元素Q、R、T、W所處的位置,可確定T、W為第三周期的元素,Q、R為第二周期元素,T所處的周期序數與族序數相等,則T為Al元素,故Q為C元素,R為N元素,W為S元素.(1)T的為Al,原子核外有3個電子層,各層電子數為2、8、3,Al的原子結構示意圖為 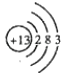 ;R的最簡單氫化物為氨氣,其電子式為
;R的最簡單氫化物為氨氣,其電子式為 ![]() ;Q的1:1型氫化物中相對分子質量最小的分子為CH≡CH,C為sp雜化,為直線分子;所以答案是:
;Q的1:1型氫化物中相對分子質量最小的分子為CH≡CH,C為sp雜化,為直線分子;所以答案是:  ;
; ![]() ;直線;(2)硫酸的酸性大于碳酸的酸性,可比較非金屬性Q<W,所以答案是:弱于;(3)W為S,其最高價氧化物的水化物濃溶液為濃硫酸,二者反應生成二氧化硫和水,該反應的化學方程式為S+2H2SO4(濃)
;直線;(2)硫酸的酸性大于碳酸的酸性,可比較非金屬性Q<W,所以答案是:弱于;(3)W為S,其最高價氧化物的水化物濃溶液為濃硫酸,二者反應生成二氧化硫和水,該反應的化學方程式為S+2H2SO4(濃) ![]() 3SO2+2H2O, 所以答案是:S+2H2SO4(濃)
3SO2+2H2O, 所以答案是:S+2H2SO4(濃) ![]() 3SO2+2H2O;(4)R為N元素,有多種氧化物,其中甲的相對分子質量最小,則甲為NO,在一定條件下,2L的甲氣體與0.5L的氧氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,設氧化產物中N元素化合價為a,根據電子轉移守恒:2(a﹣2)=0.5×4,解得a=3,所生成的R的含氧酸鹽的化學式是NaNO2 , 所以答案是:NaNO2 .
3SO2+2H2O;(4)R為N元素,有多種氧化物,其中甲的相對分子質量最小,則甲為NO,在一定條件下,2L的甲氣體與0.5L的氧氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,設氧化產物中N元素化合價為a,根據電子轉移守恒:2(a﹣2)=0.5×4,解得a=3,所生成的R的含氧酸鹽的化學式是NaNO2 , 所以答案是:NaNO2 .


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】已知甲、乙、丙、丁是四種中學化學中常見的物質,其轉化關系如圖所示。則甲和丁不可能是
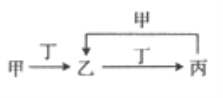
A. N2和O2 B. Cl2和Fe C. C和O2 D. SO2和NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1 L 1 mol·L-1 Na2SO4溶液中,下列各量正確的是
A.c(Na+)=1 mol·L-1 B.n(Na+)=3 mol
C.c(SO42-)=2 mol·L-1 D.m(Na2SO4)=142 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C均為短周期元素,它們在周期表中的位置如右圖.已知B、C兩元素在周期表中族序數之和是A元素族序數的2倍;B、C元素的原子序數之和是A元素原子序數的4倍,則A、B、C 所在的一組是( ) 
A.Be、Na、Al
B.B,Mg、Si
C.O,P,Cl
D.C,Al、P
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學查閱教材得知,普通鋅錳電池筒內無機物質主要成分為MnO2、NH4Cl、ZnCl2等物質。他在探究廢干電池內的黑色固體回收利用時,進行如圖所示實驗:下列有關實驗的敘述中,不正確的是

A. 操作①中玻璃棒的作用是加快固體溶解速度
B. 操作②的操作名稱是過濾
C. 操作③中盛放藥品的儀器是坩堝
D. 操作④的目的是除去濾渣中雜質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表與元素周期律在學習、研究和生產實踐中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七種元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
請回答:
(1)②所代表元素的名稱為______
(2)七種元素中,非金屬性最強的元素是______(填元素符號),最高價氧化物的水化物酸性最強的是_______(填化學式),最高正化合價與最低負化合價的代數和為4的元素是_______(填元素符號)。
(3)②、④、⑥所對應元素中原子半徑最小的是______(填元素符號),簡單離子半徑最大的是______(填離子符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了檢驗淀粉水解產物,某學生設計了如下實驗方案: 
回答下列問題:
(1)試劑1是 , 作用是;
(2)試劑2是 , 作用是 , 發生的離子反應為:; 如果實驗過程中沒有加入試劑2而直接加入試劑3,能否實現實驗目的 , 若不能,其原因是 .
(3)如何檢驗第①步實驗已基本完成 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸銅在生產、生活中應用廣泛.某化工廠用含少量鐵的廢銅渣為原料生產膽礬的流程如圖: 
(1)寫出浸出時銅與稀硫酸、稀硝酸反應生成硫酸銅的化學方程式: .
(2)取樣檢驗是為了確認Fe3+是否除凈,你的檢驗方法是 .
(3)濾渣c是 .
(4)氣體a可以被循環利用,用化學方程式表示氣體a被循環利用的原理為 2NO+O2═2NO2、 .
(5)一定溫度下,硫酸銅受熱分解生成CuO、SO2氣體、SO3氣體和O2氣體,且n(SO3):n(SO2)=1:2,寫出硫酸銅受熱分解的化學方程式: .
(6)某同學設計了如圖所示的實驗裝置分別測定生成的SO2、SO3氣體的質量和O2氣體的體積.此設計有不合理之處,請說明理由: . 
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com