
【題目】取一定質量的Cu、Cu2O、CuO的固體混合物,將其分成兩等份。其中一份通入足量的氫氣充分反應后固體質量為25.6g,另一份加入500mL稀硝酸中固體恰好完全溶解并產生標準狀況下的NO氣體4.48L。已知Cu2O+2H+=Cu+Cu2++H2O。則稀硝酸的濃度為
A. 4mo1·L-1 B. 2mo1·L-1 C. 1.6mo1·L-1 D. 0.8mo1·L-1
【答案】B
【解析】
一份用足量的氫氣還原,反應后固體質量為Cu的質量,另一份中加入500mL稀硝酸,固體恰好完全溶解,溶液中溶質為Cu(NO3)2,根據Cu元素守恒可知:n[Cu(NO3)2]=n(Cu),根據氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],再根據c=![]() 計算硝酸的濃度。
計算硝酸的濃度。
一份用足量的氫氣還原,反應后固體質量為Cu的質量,故n(Cu)=![]() =0.4mol,另一份中加入500mL稀硝酸,固體恰好完全溶解,溶液中溶質為Cu(NO3)2,根據Cu元素守恒可知:n[Cu(NO3)2]=n(Cu)=0.4mol,根據氮元素守恒可知:n(HNO3)=n(NO)+2n[Cu(NO3)2]=
=0.4mol,另一份中加入500mL稀硝酸,固體恰好完全溶解,溶液中溶質為Cu(NO3)2,根據Cu元素守恒可知:n[Cu(NO3)2]=n(Cu)=0.4mol,根據氮元素守恒可知:n(HNO3)=n(NO)+2n[Cu(NO3)2]=![]() +2×0.4mol=1mol,所以該稀硝酸的濃度為:c(HNO3)=
+2×0.4mol=1mol,所以該稀硝酸的濃度為:c(HNO3)=![]() =2mol/L,
=2mol/L,
答案選B。


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案科目:高中化學 來源: 題型:
【題目】短周期元素R、T、X、Y、Z在元素周期表的相對位置如下表所示,它們的最外層電子數之和為31。則下列判斷正確的是

A.R位于元素周期表中第二周期第ⅣA族
B.原子半徑:X<R<T
C.最簡單氣態氫化物穩定性:T>R>Y
D.最高價氧化物對應的水化物酸性:T>R>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA代表阿伏加德羅常數的值,下列說法正確的是
A. 0.5 mol鋅粒與足量鹽酸反應產生11.2 L H2 B. 0.1 mol CH4所含氫原子數為0.4NA
C. 標準狀況下,11.2 L CCl4所含分子數為0.5NA D. 常溫常壓下,28 g N2中所含原子個數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,水既不是氧化劑、也不是還原劑的氧化還原反應是
A. Mg+2H2O===Mg(OH)2+H2↑ B. 2F2+2H2O===4HF+O2
C. Na2O+H2O===2NaOH D. 2Na2O2+2H2O===4NaOH+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肼(N2H4,無色液體)是一種用途廣泛的化工原料。實驗室中先制備次氯酸鈉,再用次氯酸鈉溶液和氨反應制備肼并驗證肼的性質。實驗裝置如圖所示。
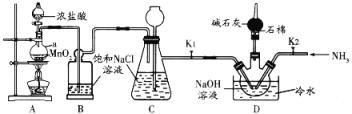
已知:Cl2(g)+2NaOH(aq)=NaC1O(aq)+NaC1(aq)+H2O(g) △H<0。當溫度超過40℃時,Cl2與NaOH溶液反應生成NaClO3。回答下列問題:
(1)儀器a的名稱是________________,裝置B的作用是____________________________。
(2)為控制D裝置中的反應溫度,除用冷水浴外,還需采取的實驗操作是________________。
(3)當三頸燒瓶中出現黃綠色氣體時立即關閉分液漏斗活塞、移去酒精燈、關閉K1。此時裝置C的作用是________________________________。
(4)將D裝置水槽中的冷水換為熱水,把三頸燒瓶中黃綠色氣體趕走后,打開K2,通入NH3,使其與NaC1O溶液反應制取肼。理論上通入三頸燒瓶的Cl2和NH3的最佳物質的量之比為______________。
(5)請從提供的下列試劑中選擇合適試劑,設計合理的實驗方案驗證肼的還原性____________(說明操作、現象和結論)。
①淀粉-KI溶液 ②稀硫酸(酚酞) ③NaHCO3 ④AgC1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子在溶液能夠大量共存的( )
A. Ca2+、Cl-、K+、CO32- B. Fe3+、Cl-、H+、SO42-
C. Fe2+、OH-、NO3-、SO42- D. HC03-、Na+、OH-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pH=1的某溶液X中僅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一種或幾種(忽略水的電離及離子的水解),取該溶液進行連續實驗,實驗過程如圖:下列有關推斷不正確的是( )
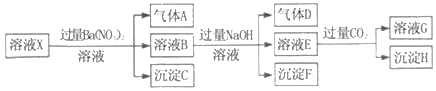
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根據上述連續實驗不能確定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H為Al(OH)3、BaCO3的混合物
D. 若溶液X為100mL,產生的氣體A為44.8mL(標準狀況),則X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.肼(N2H4)又稱聯氨,常溫時是一種可燃性液體,可用作火箭燃料。
(1)已知在25℃、101kPa時,16g N2H4在氧氣中完全燃燒生成氮氣,放出312kJ的熱量,則N2H4完全燃燒的熱化學方程式是__________________________________。
II.如下圖所示,某研究性學習小組利用上述燃燒原理設計一個肼(N2H4)─空氣燃料電池(如圖甲)并探究某些工業原理,其中乙裝置中X為陽離子交換膜(即只允許陽離子通過)。
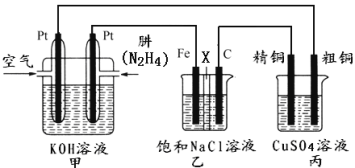
根據要求回答相關問題:
(2)甲裝置中通入________氣體的一極為正極,其電極反應式為:________________。
(3)乙裝置中石墨電極為_________極,其電極反應式為_______________;可以用__________________檢驗該反應產物,電解一段時間后,乙池中的溶液呈_______性。
(4)圖中用丙裝置模擬工業中的_________________原理,如果電解后丙裝置精銅質量增加3.2g,則理論上甲裝置中肼消耗質量為___________g。
(5)如果將丙中的粗銅電極換為Pt電極,則丙中總化學方程式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量純凈的氨基甲酸銨置于密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。能判斷該反應已經達到化學平衡的是( )
2NH3(g)+CO2(g)。能判斷該反應已經達到化學平衡的是( )
①v(NH3)正=2v(CO2)逆 ②密閉容器中總壓強不變 ③密閉容器中混合氣體的密度不變 ④密閉容器中混合氣體的平均相對分子質量不變 ⑤密閉容器混合氣體的總物質的量不變⑥密閉容器中CO2的體積分數不變 ⑦ 混合氣體總質量
A. ①②③⑤⑦ B. ①②⑤⑦ C. ①⑤⑥ D. 全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com