
【題目】現代工業的發展導致CO2的大量排放,對環境造成的影響日益嚴重,通過各國科技工作者的努力,已經開發出許多將CO2回收利用的技術,其中催化轉化法最具應用價值。回答下列問題:
(1)在催化轉化法回收利用CO2的過程中,可能涉及以下化學反應:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
從化學平衡的角度來看,上述化學反應中反應進行程度最小的是____,反應進行程度最大的是_____。
(2)反應CO2(g)+4H2(g)=CH4(g) +2H2O(g)稱為Sabatier反應,可用于載人航空航天工業。我國化學工作者對該反應的催化劑及催化效率進行了深入的研究。
①在載人航天器中利用Sabatier反應實現回收CO2再生O2,其反應過程如圖所示,這種方法再生O2的最大缺點是需要不斷補充_________(填化學式)。

②在1.5 MPa,氣體流速為20 mL·min-l時研究溫度對催化劑催化性能的影響,得到CO2的轉化率(%)如下:
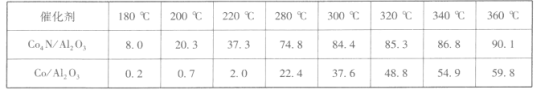
分析上表數據可知:_____(填化學式)的催化性能更好。
③調整氣體流速,研究其對某一催化劑催化效率的影響,得到CO2的轉化率(%)如下:
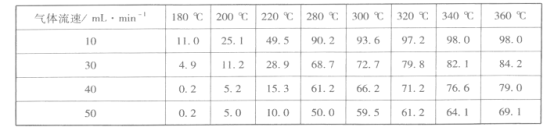
分析上表數據可知:相同溫度時,隨著氣體流速增加,CO2的轉化率____(填“增大”或“減小”),其可能的原因是_________________________________。
④在上述實驗條件中,Sabatier反應最可能達到化學平衡狀態的溫度是____,已知初始反應氣體中V(H2):V(CO2) =4:l,估算該溫度下的平衡常數為 ___________(列出計算表達式)。
(3)通過改變催化劑可以改變CO2與H2反應催化轉化的產物,如利用Co/C作為催化劑,反應后可以得到含有少量甲酸的甲醇。為了研究催化劑的穩定性,將Co/C催化劑循環使用,相同條件下,隨著循環使用次數的增加,甲醇的產量如圖所示,試推測甲醇產量變化的原因_________________________________。(已知Co的性質與Fe相似)
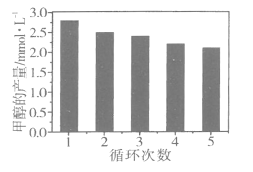
【答案】② ④ H2 Co4N/Al2O3 減小 氣流流速加快,導致反應物與催化劑接觸時間不夠 360℃  反應產生的甲酸腐蝕催化劑,使催化劑活性降低
反應產生的甲酸腐蝕催化劑,使催化劑活性降低
【解析】
(1)在溫度、壓強一定的條件下,反應總是向△G<0的方向進行,由此判斷。
(2)①分析反應過程圖,CO2、O2、H2O屬于循環過程中始終在循環過程中的,而H2屬于循環過程中加入的,由此可知正確答案;
②分析表中數據,在相同溫度下,對比不同催化劑時CO2的轉化率可選擇出催化性能更好的催化劑;
③分析表中數據,在溫度不變的情況下,氣流速度增大,CO2的轉化率逐漸降低,據此分析原因;
④分析表中數據,大部分數據顯示,在氣流速度不變的情況下,CO2的轉化率隨著溫度的增大而逐漸增大,但增大的幅度在逐漸減小,故在上述實驗條件中,Sabatier反應最可能達到化學平衡狀態的溫度是360℃,根據此時CO2的轉化率,計算該溫度下的平衡常數;
(3)由圖可知,隨著Co/C催化劑循環次數的增多,甲醇的產量逐漸降低,說明該催化劑在循環過程中受到一定程度的影響,結合產物的性質進行分析;
(1)分析四個反應,根據在溫度、壓強一定的條件下,反應總是向△G<0的方向進行,反應的△G越小反應進行程度越大,反之反應進行的程度就越小,故上述化學反應中反應進行程度最小的是②,反應進行程度最大的是④。答案為:②;④;
(2)①分析循環圖,只有H2需不斷補充,答案為:H2;
②對比表中的數據,在相同溫度下,催化劑為Co4N/Al2O3時,CO2的轉化率更大,答案為:Co4N/Al2O3;
③分析表中數據,溫度不變時,隨著氣體流速的逐漸增大,CO2的轉化率逐漸減小,可能是氣體流速過快,來不及和催化劑充分接觸,導致CO2的轉化率減小。答案為:減小;氣流流速加快,導致反應物與催化劑接觸時間不夠;
④分析表中數據,大部分數據表明,在320℃至360℃時,氣體流速不變的情況下,CO2的轉化率的增大幅度在逐漸減小,由此可知Sabatier反應最可能達到化學平衡狀態的溫度是360℃,結合題中所給信息,選擇氣體流速為10mL·min-1時CO2的轉化率進行計算。
已知初始反應氣體中V(H2):V(CO2) =4:l,根據在密閉容器里,全部由氣體參與的反應中,壓強、溫度不變時,氣體的體積比等于物質的量之比,可知V(H2):V(CO2) = n(H2):n(CO2)=4:l,設初始氣體中H2的物質的量為4mol,CO2的物質的量為1mol,則有:
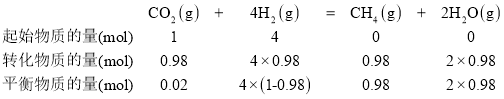
在密閉容器中,全部由氣體參與的反應中,平衡時氣體的物質的量之比=氣體物質的量濃度之比,可知該溫度下,該反應的平衡常數K=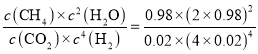 。答案為:360℃;
。答案為:360℃; ;
;
(3)根據題中催化劑循環次數和甲醇產量的關系:催化劑的循環次數越多,甲醇的產量逐漸降低,說明催化劑一定程度受到了其他物質的影響,結合題給信息:用Co/C作為催化劑,反應后可以得到含有少量甲酸的甲醇。又已知Co的性質與Fe相似,說明甲酸可與催化劑中的Co進行反應,故催化劑的活性降低,進而影響甲醇的產量,答案為:反應產生的甲酸腐蝕催化劑,使催化劑活性降低。


 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案 浙江之星學業水平測試系列答案
浙江之星學業水平測試系列答案科目:高中化學 來源: 題型:
【題目】用黃銅礦(主要成分是CuFeS2)生產粗銅的反應原理如下:

(1)已知在反應①、②中均生成相同的氣體分子,該氣體具有漂白性。請分別寫出反應①、②的化學方程式是___________________、__________________。
(2)基態銅原子的核外電子排布式為________,硫、氧元素相比,第一電離能較大的是________。
(3)反應①和②生成的氣體分子的中心原子的雜化類型是________,分子的空間構型是________。
(4)某學生用硫酸銅溶液與氨水做了一組實驗,CuSO4溶液中加氨水生成藍色沉淀,再加氨水沉淀溶解,得到深藍色透明溶液,最后向該溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶體,請解釋加入乙醇后析出晶體的原因_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方案不能達到相應目的的是
A | B | C | D | |
目的 | 比較碳酸根與碳酸氫根水解程度 | 研究濃度對化學平衡的影響 | 比較不同催化劑對化學反應速率的影響 | 比較碳酸、醋酸和硼酸的酸性強弱 |
實驗方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】低濃度的氫氟酸是一元弱酸,存在下列兩個平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (較穩定)。25℃時,不同酸性條件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)與溶液pH(忽略體積變化)的變化關系如圖所示。下列說法正確的是( )
HF2- (較穩定)。25℃時,不同酸性條件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)與溶液pH(忽略體積變化)的變化關系如圖所示。下列說法正確的是( )
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)時,溶液一定呈堿性
C.隨著溶液pH增大,![]() 不斷增大
不斷增大
D.25℃時,HF的電離常數Ka=10-3.45
查看答案和解析>>
科目:高中化學 來源: 題型:
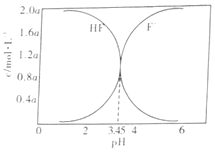
【題目】下圖是2SO3(g)![]() 2SO2(g)+O2(g)的能量變化圖,據圖得出的相關敘述正確的是( )
2SO2(g)+O2(g)的能量變化圖,據圖得出的相關敘述正確的是( )
A. 該化學反應過程中既有能量的吸收又有能量的釋放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器內有2 mol SO3充分反應,吸收(a-b) kJ熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用系統命名法寫出下列物質名稱或結構簡式或者對應的化學方程式:
(1) ______________________________。
______________________________。
(2)實驗室制取乙炔的化學方程式為:_________________________________________。
(3)乙醇的消去反應:________________________________________________;
(4)3-甲基-1-丁烯:_________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設反應①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常數為K1;反應②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常數為K1;反應②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常數為K2。測得在不同溫度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常數為K2。測得在不同溫度下,K1、K2值如下:
溫度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃時進行反應①,CO2的轉化率為_______________。
(2)900 ℃時進行反應③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常數K3=______________。
H2O(g)+CO(g),其平衡常數K3=______________。
(3)反應②的焓變ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃時反應②達到化學平衡,要使該平衡向正反應方向移動,當其他條件不變時,可采取的措施有___________________________________。
A.縮小容器容積 B.加入更多的水蒸氣
C.升高溫度至900 ℃ D.使用合適的催化劑
(5)下列圖像符合反應①的是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學反應方程式為_____________。利用反應6NO2+ 8NH3![]() 7N2+12 H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是________L。
7N2+12 H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
a 體系壓強保持不變 b 混合氣體顏色保持不變
c SO3和NO的體積比保持不變 d 每消耗1 mol SO3的同時生成1 molNO2
該溫度下,此反應的平衡常數表達式K=__________。
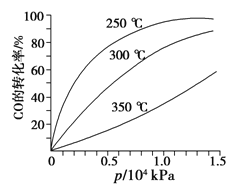
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應ΔH______0(填“>”或“ <”)。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應ΔH______0(填“>”或“ <”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)糖類、油脂、蛋白質和維生素都是人類的基本營養物質,下表為某品牌燕麥片標簽中的一部分。

該燕麥片的營養成分中,能與水反應生成氨基酸的營養物質是_________,每克營養物質氧化時放出能量最多的是_________,一般營養、健康類雜志中提到的“碳水化合物”是指_________,人體必需的微量元素是_________;
(2)維生素C易溶于水,向其水溶液中滴入紫色石蕊試液,石蕊變紅色,加熱該溶液至沸騰,紅色消失,因此,烹調富含維生素C的食物時,應該注意_________;在堿性條件下,維生素C易被空氣氧化,燒煮時最好加一點_________;
(3)我們穿的衣服通常是由纖維織成的,常見的纖維有棉花、羊毛、滌綸等.用灼燒法可初步鑒別三種纖維,給三種纖維編號后,分別灼燒產生的氣味如下:

則羊毛的編號為_________,棉花的編號為_________,滌綸的編號為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com