
(10分)運用化學反應原理研究氮、氧等單質及其化合物的反應有重要意義。
(1)合成氨反應N2(g)+3H2(g) 2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡
移動(填“向左”、“向右”或“不”);使用催化劑反應的△H
(填“增大”、“減小”或“不改變”)。
2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡
移動(填“向左”、“向右”或“不”);使用催化劑反應的△H
(填“增大”、“減小”或“不改變”)。
(2)已知:O2(g) = O2+(g)+e-
 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
則反應O2(g)+PtF6(g)
= O2+PtF6-(s)的  H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定溫度下,一定體積的密閉容器中充入NO2進行反應:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定溫度下,一定體積的密閉容器中充入NO2進行反應:2NO2(g) N2O4(g)達到平衡。寫出該反應的平衡常數表達式: ,升高溫度,該反應的平衡常數K值將 (填增大或減小或不變); 若其他條件不變時,下列措施能提高NO2轉化率的是 (填字母序號)
N2O4(g)達到平衡。寫出該反應的平衡常數表達式: ,升高溫度,該反應的平衡常數K值將 (填增大或減小或不變); 若其他條件不變時,下列措施能提高NO2轉化率的是 (填字母序號)
 A.減小NO2的濃度 B.降低溫度 C.增加NO2的物質的量 D.升高溫度
A.減小NO2的濃度 B.降低溫度 C.增加NO2的物質的量 D.升高溫度
(4)在25℃下,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合,反應時溶液中c(NH4+)=c(Cl-)。則溶液顯 性(填“酸”、“堿”或“中”);用含a的代數式表示NH3·H2O的電離常數Kb= 。
(1)向左 不改變 (2)-77.6 (3)c(N2O4)/c2(NO2) 減小 BC
(4)中 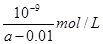
【解析】(1)在恒壓條件下加入氬氣,則容積增大,導致原平衡中各物質的濃度同等比例減小,所以平衡向氣體體積增大的方向即向左移動;催化劑僅是改變化學反應速率,不會影響焓變。
(2)根據蓋斯定律,將化學方程式①+②-③疊加即得到O2(g)+PtF6(g) = O2+PtF6-(s)。
(3)平衡常數是指在一定條件下的可逆反應中,當反應達到平衡時生成物濃度的冪之積和反應物濃度的冪之積的比值。因為反應是放熱反應,所以升高溫度,平衡向逆反應方向移動,平衡常數減小。減小反應物濃度平衡向逆反應方向移動,轉化率降低。溫度降低平衡向正反應方向移動,轉化率增大,升高溫度正好相反。因為反應物和生成物都只有一種,所以增加NO2的物質的量,相當于增大壓強,平衡向正反應方向移動,轉化率增大。
(4)由溶液的電荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),則有c(H*)=c(OH-),溶液顯中性;電離常數只與溫度有關,則此時NH3·H2O的電離常數
Kb=[c(NH4*)·c(OH-)]/c(NH3·H2O)=(0.01mol·L-1·10-7mol·L-1)/(amol·L-1-0.01mol·L-1)
= 10-9/( (a-0.01)mol·L-1。


 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
| ||
| (一定條件) |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com