
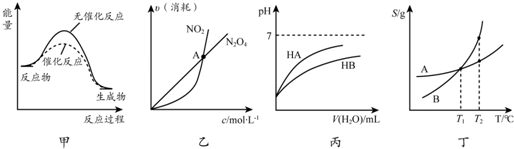
| A. | 由甲可知:使用催化劑不影響反應熱 | |
| B. | 由乙可知:對于恒溫恒容條件下的反應2NO2(g)?N2O4(g),A點為平衡狀態 | |
| C. | 由丙可知:同溫度、同濃度的NaA溶液與NaB溶液相比,其pH前者小于后者 | |
| D. | 由丁可知:將T1℃的A、B飽和溶液升溫至T2℃時,A與B溶液的質量分數相等 |
分析 A.催化劑改變反應速率不改變化學平衡,反應熱不變;
B.化學方程式可知二氧化氮和四氧化二氮反應速率之比等于星峰傳說計量數之比為2:1,化學平衡狀態需要正逆反應速率相同;
C.加入水稀釋相同倍數,HA酸溶液PH增大的多,說明HA酸性大于HB,酸越弱對應鹽水解程度越大,堿性越強;
D.將T1℃的A、B飽和溶液升溫至T2℃時,溶液中溶質溶解度增大,變為不飽和溶液,
解答 解:A.催化劑能降低反應的活化能,加快反應速率化學平衡不變,反應的反應熱不變,故A正確;
B.對于恒溫恒容條件下的反應2NO2(g)?N2O4(g),圖象中的A點是二氧化氮和四氧化二氮的消耗速率相同,但不能說明正逆反應速率相同,只有二氧化氮消耗速率為四氧化二氮消耗速率的二倍時才能說明反應達到平衡狀態,故B錯誤;
C.圖象分析可知加入水稀釋相同倍數,HA酸溶液PH增大的多,說明HA酸性大于HB,酸越弱對應鹽水解程度越大,堿性越強,所以同溫度、同濃度的NaA溶液與NaB溶液相比,其pH前者小于后者,故C正確;
D.將T1℃的A、B飽和溶液升溫至T2℃時,溶液中溶質溶解度增大,變為不飽和溶液,但溶液濃度和T1點的飽和溶液溶質質量分數相同,故D正確;
故選B.
點評 本題考查了圖象變化實質的分析判斷,主要是化學平衡影響因素、鹽類水解原理、弱電解質電離平衡的影響因素、溶質質量分數的分析判斷等知識,題目難度中等.


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、Cl-、CO32- | B. | H+、Na+、Fe2+、NO3- | ||
| C. | K+、Ca2+、Cl-、NO3- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
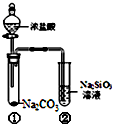
| A. | 向Na2SiO3溶液中直接滴入鹽酸溶液無明顯現象 | |
| B. | 試管①中反應的離子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 該實驗可以證明酸性:鹽酸>碳酸>硅酸 | |
| D. | 一段時間后試管②中有膠凍狀物質生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體A的平衡轉化率大于氣體B平衡轉化率 | |
| B. | 平衡后若減小該體系的壓強,則平衡向左移動,化學平衡常數減小 | |
| C. | 物質D的聚集狀態一定是氣體 | |
| D. | 平衡后升高溫度,若平衡向左移動,則正反應的△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 該混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 該混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- | |
| D. | 該混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時,電池的陽極反應為LiC6-e=Li++C6 | |
| B. | 放電時,電池的正極反應為 CoO2+Li++e-=LiCoO2 | |
| C. | 乙酸、乙醇等含活潑氫的有機物可做該鋰離子電池的電解質 | |
| D. | 該鋰離子電池的比能量(消耗單位質量電極所釋放的電量)比鉛蓄電池低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com