
下列有關酸堿反應的分析判斷不正確的是
A.0.1mol.L-1CH3COOH與0.1mol.L-1 NaOH溶液等體積混合后,溶液中離子濃度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.pH=2的鹽酸與pH=12的氨水等體積混合后的溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.常溫下,向10mlpH=12的NaOH溶液中加入pH=2的HA至pH=7,所得溶液的總體積V≥20ml
D.某溫度下,Ba(OH)2溶液中KW=10-12,向pH=8的該溶液中加入等體積pH=4的鹽酸,混合溶液pH=6
C
【解析】
試題分析:A、0.1mol.L-1CH3COOH與0.1mol.L-1 NaOH溶液等體積混合后,二者恰好反應生成醋酸鈉。醋酸鈉水解,溶液顯堿性,因此溶液中離子濃度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),A正確;B、氨水是弱堿,溶液中存在電離平衡。因此pH=12的氨水溶液的濃度大于0.01mol/L,所以pH=2的鹽酸與pH=12的氨水等體積混合后氨水過量,溶液顯堿性,則溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+),B正確;C、如果HA是強酸,則二者恰好反應溶液顯中性,所以常溫下,向10mlpH=12的NaOH溶液中加入pH=2的HA至pH=7,所得溶液的總體積V=20ml;如果HA是弱酸,則pH=2的HA溶液濃度大于0.01mol/L。因此與等體積的pH=2的氫氧化鈉溶液混合反應,HA過量,溶液顯酸性。所以要使溶液顯中性,HA的體積應該小于10ml,所以所得溶液的總體積V<20ml,C不正確;D、某溫度下,Ba(OH)2溶液中KW=10-12,因此pH=8的氫氧化鋇溶液中OH-濃度是10-4mol/L,所以向pH=8的該溶液中加入等體積pH=4的鹽酸,二者恰好反應時,溶液顯中性,因此混合溶液pH=6,D正確,答案選C。
考點:考查酸堿中和反應的溶液酸堿性判斷、離子濃度大小比較以及水的離子積常數和pH的計算


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| 錯誤觀點 | 離子方程式 | |
| ① | 所有的離子方程式均可以表示一類反應 | |
| ② | 所有酸堿中和反應均可表示為:H++OH-=H2O |
查看答案和解析>>
科目:高中化學 來源:2010年湖北省襄樊市四校聯考高一上學期期中考試化學試題 題型:填空題
(12分)離子反應是中學化學中重要的反應類型。回答下列問題:
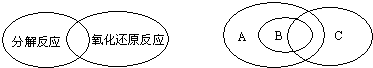
(1)人們常用圖示的方法表示不同反應類型之間的關系。如分解反應和氧化還原反應可表示為下左圖。下右圖為離子反應、氧化還原反應和置換反應三者之間的關系,則表示離子反應、氧化還原反應、置換反應的字母分別是 
(2)將NaBr溶液加入AgC1沉淀中,產生AgBr黃色沉淀。從離子反應發生的條件分析,AgCl與AgBr相比較,溶解度較大的是 。
(3)離子方程式是重要的化學用語。下列是有關離子方程式的一些錯誤觀點,請在下列表格中用相應的“離子方程式”否定這些觀點。www.tesoon.com反應物從下列物質中選取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
| | 錯誤觀點 | “否定的”離子方程式 |
| ① | 所有堿溶液與CO2反應均可以表示為: 2OHˉ+CO2 =H2O+ CO32— | |
| ② | 所有酸堿中和反應均可表示為: H++OHˉ=H2O | |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建省三明市高三第二次月考化學試卷(解析版) 題型:填空題
(6分)離子反應是中學化學中重要的反應類型。回答下列問題:
(1)人們常用圖示的方法表示不同反應類型之間的關系。如分解反應和氧化還原反應可表示為下左圖。下右圖為離子反應、氧化還原反應和置換反應三者之間的關系,則表示離子反應、氧化還原反應、置換反應的字母分別是 。

(2)離子方程式是重要的化學用語。下列是有關離子方程式的一些錯誤觀點,請在下列表格中用相應的“離子方程式”否定這些觀點。
反應物從下列物質中選取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2
|
|
錯誤觀點 |
離子方程式 |
|
① |
所有的離子方程式均可以表示一類反應 |
|
|
② |
所有酸堿中和反應均可表示為:H++OH-=H2O |
|
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三5月模擬考試理科綜合化學試卷(解析版) 題型:填空題
(15分)某研究小組對一元有機弱酸HA在溶劑苯和水的混合體系中溶解程度進行研究。在25℃時,弱酸HA在水中部分電離,HA的電離度為0.10;在苯中部分發生雙聚,生成(HA)2。該平衡體系中,一元有機弱酸HA在溶劑苯(B)和水(W)中的分配系數為K,K=C(HA)B/C(HA)W=1.0,即達到平衡后,以分子形式存在的HA在苯和水兩種溶劑中的比例為1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡體系(苯、水、HA) |
平衡常數 |
焓變 |
起始總濃度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列問題:
(1)計算25℃時水溶液中HA的電離平衡常數K1= 。
(2)25℃,該水溶液的pH為 ,在苯體系中HA的轉化率為__________。
(3)25℃混合體系中,HA在苯中發生二聚,若測得某時刻溶液中微粒濃度滿足 ,則反應向_______方向進行。
,則反應向_______方向進行。
(4)在苯中,HA自發進行發生二聚:2HA (HA)2, 已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是
。
(HA)2, 已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是
。

(5)下列有關該混合體系說法不正確的是 。
A.用分液漏斗分離得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,則上述平衡均正移,且c(HA)均減小。
B.升高溫度,HA的電離平衡常數K1和2HA  (HA)2的平衡常數K2均變大。
(HA)2的平衡常數K2均變大。
C.若用酸堿中和滴定的分析方法,可以測出HA的起始總濃度。
D.在25℃時,若再加入一定量的HA固體,則水和苯中HA的起始總濃度之比仍為3:4。
(6)在25℃時,用0.1000mol/L氫氧化鈉溶液滴定20.00mL 0.1000mol/L HA水溶液,請在下圖中畫出滴定曲線示意圖。

查看答案和解析>>
科目:高中化學 來源:2010年湖北省襄樊市四校聯考高一上學期期中考試化學試題 題型:填空題
(12分)離子反應是中學化學中重要的反應類型。回答下列問題:
(1)人們常用圖示的方法表示不同反應類型之間的關系。如分解反應和氧化還原反應可表示為下左圖。下右圖為離子反應、氧化還原反應和置換反應三者之間的關系,則表示離子反應、氧化還原反應、置換反應的字母分別是

(2)將NaBr溶液加入AgC1沉淀中,產生AgBr黃色沉淀。從離子反應發生的條件分析,AgCl與AgBr相比較,溶解度較大的是 。
(3)離子方程式是重要的化學用語。下列是有關離子方程式的一些錯誤觀點,請在下列表格中用相應的“離子方程式”否定這些觀點。反應物從下列物質中選取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
|
|
錯誤觀點 |
“否定的”離子方程式 |
|
① |
所有堿溶液與CO2反應均可以表示為: 2OHˉ+CO2 =H2O+ CO32— |
|
|
② |
所有酸堿中和反應均可表示為: H++OHˉ=H2O |
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com