
【題目】在一固定容積為2 L的密閉容器中加入2 molA和3 molB,保持溫度為30℃,在催化劑存在的條件下進行下列反應:2A(g)+3B(g) ![]() 3C(g),2分鐘達到平衡,生成1.5 mol C,此時,平衡混合氣中C的體積分數為ω1;若將溫度升高到70℃后,其他條件均不變,當反應重新達到平衡時,C的物質的量為2.1 mol,體積分數為ω2,請回答下列問題,
3C(g),2分鐘達到平衡,生成1.5 mol C,此時,平衡混合氣中C的體積分數為ω1;若將溫度升高到70℃后,其他條件均不變,當反應重新達到平衡時,C的物質的量為2.1 mol,體積分數為ω2,請回答下列問題,
(1)該反應在30℃時平衡常數K1=_________ ,焓變△H_______0(填“>”、“<”或“=”)。
(2)從反應開始到達到化學平衡狀態v(A)____________mol/(L·min)
(3)該反應在70℃時平衡常數為K2,則 K1_______K2(填“>”、“=”或“<”)
(4)可以判斷2A(g)+3B(g) ![]() 3C(g) 反應已經達到平衡(____)
3C(g) 反應已經達到平衡(____)
A.2v(B)=3v(A)
B.密閉容器中總壓強不變
C. 密閉容器中混合氣體的密度不變
D.混合氣體的平均相對分子質量不再改變
E.n(A)∶n(B)∶n(C)=2∶3∶3
【答案】4 > 0.25 < BD
【解析】
(1)2min達平衡,平衡時C為1.5mol,據此利用三段式計算平衡時各組分的平衡濃度,代入平衡常數表達式計算;根據溫度對平衡狀態的影響分析判斷;
(2)根據v=△n/(V·△t)計算v(C),再利用速率之比等于化學計量數之比計算v(A);
(3)根據溫度對平衡狀態的影響分析判斷;
(4)化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不變、含量不變,由此衍生的一些物理量也不變,據此結合選項判斷。
(1)2min達平衡,平衡時C為1.5mol,C的平衡濃度為1.5mol÷2L=0.75mol/L,則:
2A(g)+3B(g)![]() 3C(g)
3C(g)
開始(mol/L):1 1.5 0
變化(mol/L):0.5 0.75 0.75
平衡(mol/L):0.5 0.75 0.75
故30℃平衡常數k=0.753/(0.52×0.753)=4
由題意可知,升高溫度平衡時C的物質的量增大,說明升高溫度平衡向正反應方向移動,故正反應為吸熱反應,即△H>0;
(2)2min達平衡,平衡時C為1.5mol,C的平衡濃度為1.5mol÷2L=0.75mol/L,用C表示的反應速率是0.75mol/L÷2min=0.375mol/(Lmin)。反應速率之比等于化學計量數之比,所以v(A)=2/3v(C)=2/3×0.375mol/(Lmin)=0.25mol/(Lmin);
(3)升高溫度平衡向正反應方向移動,說明溫度越高平衡常數越大,故K1<K2;
(4)A.未指明正逆速率,不能說明到達平衡,故A錯誤;
B.隨反應進行,反應混合物的物質的量減小,壓強降低,密閉容器中總壓強不變,說明到達平衡,故B正確;
C.混合氣體的總質量不變,容器的體積不變,容器中混合氣體的密度始終不變,不能說明到達平衡,故C錯誤;
D.混合氣體的總質量不變,隨反應進行,反應混合物的物質的量減小,混合氣體的平均相對分子質量增大,當混合氣體的平均相對分子質量不再改變,說明到達平衡,故D正確;
E.平衡時各組分的物質的量之比不一定等于化學計量數之比,與開始的物質的量及轉化率有關,當n(A)∶n(B)∶n(C)=2∶3∶3時不能說明到達平衡,故E錯誤;
故答案為BD。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】室溫下,用0.l00mol/L NaOH溶液分別滴定20.00 mL 0.100 mol/L的鹽酸和醋酸,滴定曲線如圖所示。下列說法正確的是

A. II表示的是滴定醋酸的曲線
B. pH=7時,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL時,兩份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL時,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2回收與利用是環境科學家研究的熱點課題。利用CO2制備合成氣(CO、H2),再制備高值產品,如甲醇等,也可以利用CO2直接制備甲醇等產品。
(1)已知幾種反應的正反應活化能(E1)、逆反應活化能(E2)如表所示:
序號 | 化學反應 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同條件下,起始反應最快的是____(填序號)。由H2和CO合成氣態甲醇的熱化學方程式為________。
(2)T1℃下,在2L恒容密閉容器中充入0.20mol CO和0.60mol H2合成CH3OH,發生反應:CO(g)+2H2(g)![]() CH3OH(g) △H<0,經5min恰好達到平衡,CH3OH的濃度是0.05mol·L-1。
CH3OH(g) △H<0,經5min恰好達到平衡,CH3OH的濃度是0.05mol·L-1。
①T1℃時,以H2表示的反應的平均速率為___,平衡常數K=____。
②(T1+100)℃時,在1L恒容密閉容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此時反應將____(填“向左移動”“向右移動”“達到平衡”或“無法判斷”)。
(3)CO2和H2在催化劑作用下反應,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,測得相同時間內甲醇產率與溫度的關系如圖所示。
CH3OH(g)+H2O(g) △H<0,測得相同時間內甲醇產率與溫度的關系如圖所示。
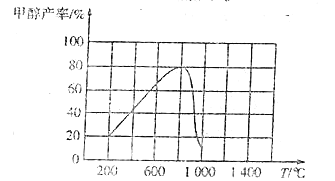
①溫度在800℃時甲醇產率最高的主要原因是/span>____。
②下列措施能提高CO2平衡轉化率的是____(填字母)。
A.升溫 B.加壓 C.加入催化劑 D.增大H2濃度
(4)利用電解法在酸性條件下將CO2和H2O轉化或CO和H2,陰極反應式之一為CO2+2e-+2H+=CO+H2O,其機理如下:①CO2+2e-+H2O===CO+2OH-(慢反應);②OH-+CO2=HCO3-(快反應);③HCO3-+H+=CO2+H2O(快反應)。其中水的作用是___;控制陰板反應速率的反應是___(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水蘊含著豐富的資源。在化學實驗室里模擬從海水中提取重要的工業原料時,設計了以下操作流程:
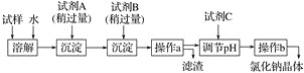
請回答以下問題:
(1)在所提供的試劑中選擇:試劑B是____。
①Na2CO3 ②BaCl2 ③稀鹽酸
(2)操作b中用到的主要儀器為酒精燈、____、三腳架和玻璃棒。

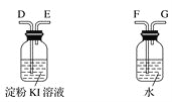
(3)利用所得的氯化鈉制氯氣和氫氣,并檢驗氯氣的氧化性和測定產生氫氣的體積。試按上圖所給儀器,設計一套能完成以上實驗目的裝置,儀器接口的正確連接順序是:
A接___,___接____;B接____,____接____。
(4)電解氯化鈉溶液時的離子方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,一定溫度下,冰醋酸加水稀釋過程中溶液的導電能力曲線圖,請回答。

(1)“O”點為什么不導電___________________。
(2)a、b、c三點的氫離子濃度由小到大的順序為____________。
(3)a、b、c三點中,醋酸的電離程度最大的一點是_________。
(4)若使c點溶液中的c(CH3COO-)提高,在如下措施中,可選擇__________。
A.加熱 B.加很稀的NaOH溶液 C.加固體KOH D.加水
E.加固體CH3COONa F.加Zn粒 G.加MgO固體 H.加Na2CO3固體
(5)在稀釋過程中,隨著醋酸濃度的降低,下列始終保持增大趨勢的量是______________。
A.c(H+) B.H+個數 C.CH3COOH分子數 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃料電池是目前電池研究的熱點之一,現有某課外小組自制的氫氧燃料電池,如圖所示,a、b均為惰性電極。下列敘述正確的是
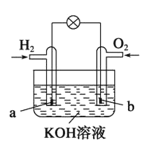
A.總反應方程式為2H2+O2![]() 2H2O
2H2O
B.a極反應是H2-2e-=2H+
C.使用過程中電解質溶液的pH逐漸減小
D.b電極是正極,該電極上發生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用右圖所示裝置進行下列實驗,能得出相應實驗結論的是( )
選項 | ① | ② | ③ | 實驗結論 | 實驗裝置 |
A | 稀硫酸 | Na2S | AgNO3與AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 濃硫酸 | 蔗糖 | 溴水 | 濃硫酸具有脫水性、氧化性 | |
C | 稀鹽酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2與可溶性鋇鹽均可以生成白色沉淀 | |
D | 濃硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S和SO2會對環境和人體健康帶來極大的危害,工業上采取多種方法減少這些有害氣體的排放,回答下列各方法中的問題。
Ⅰ.H2S的除去
方法1:生物脫H2S的原理為:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是______________。
(2)由圖3和圖4判斷使用硫桿菌的最佳條件為______________。若反應溫度過高,反應速率下降,其原因是______________。

方法2:在一定條件下,用H2O2氧化H2S
(3)隨著參加反應的n(H2O2)/n(H2S)變化,氧化產物不同。當n(H2O2)/n(H2S)=4時,氧化產物的分子式為__________。
Ⅱ.SO2的除去
方法1(雙堿法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)寫出過程①的離子方程式:____________________________;CaO在水中存在如下轉化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
從平衡移動的角度,簡述過程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的濃度為2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。將SO2通入該氨水中,當c(OH)降至1.0×107 mol·L1時,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室配制500mL0.1mol/LNa2CO3溶液,回答下列問題
(1)配制Na2CO3溶液時需用的主要儀器有托盤天平、濾紙、燒杯、藥匙、___。
(2)容量瓶上標有刻度線、___,使用前要___。
(3)需用托盤天平稱取Na2CO3____g。
(4)若實驗遇下列情況,溶液的濃度是偏高,偏低還是不變?
A.加水時超過刻度線___,
B.溶解后未冷卻到室溫就轉入容量瓶___,
C.容量瓶內壁附有水珠而未干燥處理___,
D.定容時仰視___,
E.上下顛倒搖勻后液面低于刻線___。
(5)若實驗室中要用濃度為16mol/L的濃硫酸配制480mL2.0mol/L的稀硫酸,則需要量取濃硫酸的體積為___mL。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com