
【題目】直接排放含SO2的煙氣會危害環境。利用工業廢堿渣(主要成分Na2CO3)可吸收煙氣中的SO2并制備無水Na2SO3,其流程如圖1。
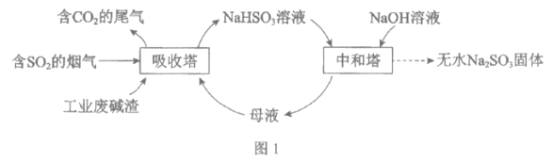
已知:H2SO3、HSO3-、SO32-在水溶液中的物質的量分數隨pH的分布如圖2, Na2SO3·7H2O和Na2SO3的溶解度曲線如圖3。
(1)Na2CO3溶液顯堿性,用離子方程式解釋其原因:______________。
(2)吸收煙氣
①為提高NaHSO3的產率,應控制吸收塔中的pH為______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),結合方程式解釋其原因:____________。
③已知下列反應:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的熱化學方程式是______________。
④吸收塔中的溫度不宣過高,可能的原因是______________(寫出1種即可)。
(3)制備無水Na2SO3:將中和塔中得到的Na2SO3溶液______________(填操作),過濾出的固體用無水乙醇洗滌、干燥,得無水Na2SO3固體。
【答案】CO32-+H2O![]() OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-
OH-+HCO3- 4~5 溶液中,HSO3-存在:HSO3-![]() H++SO32-和HSO3-+H2C
H++SO32-和HSO3-+H2C![]() H2SO3+OH-,HSO3-的電離程度強于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g)
H2SO3+OH-,HSO3-的電離程度強于水解程度 2SO2(g)+CO32-(aq)+H2O(1)=2HSO3-(aq)+CO2(g) ![]() 防止SO2的溶解度下降;防止HSO3-受熱分解;防止HSO3-的氧化速率加快等 隔絕空氣,加熱濃縮至有大量固體析出,高于34℃過濾
防止SO2的溶解度下降;防止HSO3-受熱分解;防止HSO3-的氧化速率加快等 隔絕空氣,加熱濃縮至有大量固體析出,高于34℃過濾
【解析】
(1)Na2CO3為強堿弱酸鹽,水解呈堿性;
(2)①由圖象可知pH在4~5時NaHSO3的物質的量分數最高;
②NaHSO3溶液中c(SO32-)>c(H2SO3),說明HSO3-電離程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用蓋斯定律將①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的熱化學方程式;
④HSO3-不穩定,易分解,如溫度過高,可導致氣體的溶解度下降,且HSO3-易被氧化;
(3)得無水Na2SO3固體,溫度應高于34℃,且防止被氧化。
(1)Na2CO3為強堿弱酸鹽,水解呈堿性,離子方程式為CO32-+H2O![]() OH-+HCO3-;
OH-+HCO3-;
(2)①由圖象可知pH在4~5時NaHSO3的物質的量分數最高;
②NaHSO3溶液中存在HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,c(SO32-)>c(H2SO3),說明HSO3-電離程度大于水解程度;
H2SO3+OH-,c(SO32-)>c(H2SO3),說明HSO3-電離程度大于水解程度;
③已知:①SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1=-164.3kJmol-1,②CO2(g)+2OH- (aq)═CO32- (aq)+H2O(l)△H2=-109.4kJmol-1,③2HSO3- (aq)═SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,利用蓋斯定律將①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的熱化學方程式為2SO2(g)+CO32-(aq)+H2O(l)═2HSO3-(aq)+CO2 (g)△H=-88.9 kJmol-1;
④HSO3-不穩定,易分解,如溫度過高,可導致氣體的溶解度下降,且HSO3-易被氧化,則吸收塔的溫度不易過高;
(3)得無水Na2SO3固體,溫度應高于34℃,且防止被氧化,可隔絕空氣,加熱濃縮至有大量固體析出。


 靈星計算小達人系列答案
靈星計算小達人系列答案 孟建平錯題本系列答案
孟建平錯題本系列答案科目:高中化學 來源: 題型:
【題目】關于下列各圖的敘述不正確的是( )
化學方程式 | 平衡常數K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |
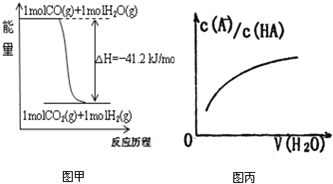
A.已知CO的燃燒熱283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,則圖甲表示CO和H2O(g)生成CO2和H2的能量變化
B.某溫度下,pH =11的NH3H2O和pH =1的鹽酸等體積混合后(不考慮混合后溶液體積的變化)恰好完全反應,反應后的溶液中NH4+、NH3H2O與NH3三種微粒的平衡濃度之和為0.05molL-1
C.在常溫下,X2(g) 和 H2反應生成HX的平衡常數如表乙所示,僅依據K的變化,就可以說明在相同條件下,平衡時X2(從F2到I2)的轉化率逐漸降低,且X2與H2反應的劇烈程度逐漸減弱
D.圖丙中曲線表示常溫下向弱酸HA的稀溶液中加水稀釋過程中,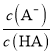 的變化情況
的變化情況
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是部分短周期元素原子半徑與原子序數的關系,則下列說法正確的是( )

A.M在周期表中的位置為:第三周期,IV族
B.Y、Z、M、N四種元素形成的原子半徑最大的是Y
C.X、N兩種元素的氣態氫化物的沸點相比,前者較低
D.Y元素和X元素可以形成Y2X2型化合物,陰、陽離子物質的量之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將綠礬(FeSO47H2O)隔絕空氣條件下加強熱分解,已知產物全部為氧化物,為探究綠礬分解的反應產物,某同學進行了以下實驗:
(實驗一)為探究固體產物中鐵元素的價態,該同學將固體產物溶于足量的稀硫酸得到相應的溶液,進行以下猜想和實驗:
猜想 | 實驗操作 | 預期現象 |
猜想一:鐵元素只顯_______價 | ① 取溶液樣品,滴入KSCN溶液;②取溶液樣品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液無明顯現象稀酸性KMnO4溶液顏色______ |
猜想二:鐵元素只顯_______價 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液顏色無變化 | |
猜想三:鐵元素顯+2,+3價 | 加入KSCN溶液呈血紅色;稀酸性KMnO4溶液顏色褪色 |
(實驗二)為進一步探究該反應的產物,進行了如下圖所示的實驗:
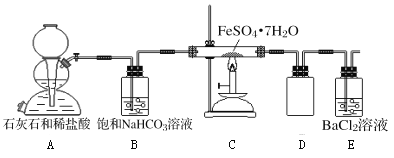
(1)實驗開始時,點燃C處酒精噴燈之前應先打開A處活塞通CO2,其目的是_________。
(2)飽和NaHCO3的作用是______,其水溶液呈堿性的原因(用離子方程式解釋)____________。
(3)該組同學稱取了55.6克綠礬按如圖裝置進行試驗,待綠礬分解完全后,E瓶中只出現白色沉淀且質量為23.3克;C中固體產物加入足量稀硫酸中,固體產物全部溶解,取溶液樣品,加入KSCN,溶液呈血紅色,取另一份溶液,加入酸性KMnO4,不褪色。根據這些實驗現象和數據,可以得知綠礬分解的化學方程式為____________________________。
(4)該組同學設計的裝置存在著一個明顯的缺陷是__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是工業電解飽和食鹽水的裝置示意圖,下列有關說法中不正確的是( )

A.裝置中出口①處的物質是氯氣,出口②處的物質是氫氣
B.該離子交換膜只能讓陽離子通過,不能讓陰離子通過
C.裝置中發生反應的離子方程式為Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.該裝置是將電能轉化為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碲(52Te)被譽為“國防與尖端技術的維生素”。工業上常用銅陽極泥(主要成分是Cu2Te、含Ag、Au等雜質)為原料提取碲并回收金屬,其工藝流程如圖:
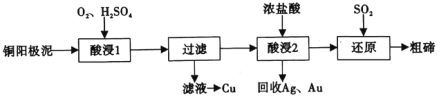
已知:TeO2微溶于水,易與較濃的強酸、強堿反應。回答下列問題:
(1)已知Te為VIA族元素,TeO2被濃NaOH溶液溶解,所生成鹽的化學式為___。
(2)“酸浸1”過程中,為加快浸出速率,可采取的方法有___(填1種)。“酸浸2”時溫度過高會使Te的浸出率降低,原因是___。
(3)“酸浸1”過程中,控制溶液的酸度使Cu2Te轉化為TeO2,反應的化學方程式為___;“還原”過程中,發生反應的離子方程式為___。
(4)工業上也可用電解法從銅陽極泥中提取碲,方法是:將銅陽極泥在空氣中焙燒使碲轉化為TeO2,再用NaOH溶液堿浸,以石墨為電極電解所得溶液獲得Te。電解過程中陰極上發生反應的電極方程式為___。在陽極區溶液中檢驗出有TeO42-存在,生成TeO42-的原因是___。
(5)常溫下,向lmol·L-1 Na2TeO3溶液中滴加鹽酸,當溶液pH=5時,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究外界條件對反應:mA(g)+nB(g)![]() cZ(g) ΔH的影響,以A和B的物質的量之比為m∶n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )
cZ(g) ΔH的影響,以A和B的物質的量之比為m∶n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )

A.ΔH>0
B.m+n<c
C.升高溫度,υ正、υ逆都增大,平衡常數減小
D.恒溫恒壓時,向已達平衡的體系中加入少量Z(g),再次達到平衡后Z的物質的量分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2O2是一種二元弱酸,對于0.1mol·L1的過氧化氫溶液,下列敘述不正確的是()
A.H2O2的電離方程式可寫作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀釋過程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量濃鹽酸,過氧化氫的電離平衡逆向移動,水的電離平衡逆向移動
D.加入少量氯化鐵溶液,溶液中產生大量氣泡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組以AgZSM為催化劑,在容積為1 L的容器中,相同時間下測得0.1 mol NO轉化為N2的轉化率隨溫度變化如圖所示[無CO時反應為2NO(g)![]() N2(g)+O2(g);有CO時反應為2CO(g)+2NO(g)
N2(g)+O2(g);有CO時反應為2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)]。下列說法正確的是 ( )
2CO2(g)+N2(g)]。下列說法正確的是 ( )

A.反應2NO![]() N2+O2的ΔH>0
N2+O2的ΔH>0
B.達平衡后,其他條件不變,使n(CO)/n(NO)>1,CO轉化率下降
C.X點可以通過更換高效催化劑提高NO轉化率
D.Y點再通入CO、N2各0.01 mol,此時v(CO,正)<v(CO,逆)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com