
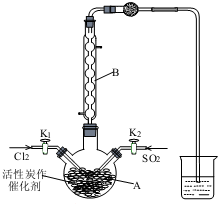
 磺酰氯(SO2Cl2)用于有機合成、醫藥、染料、農藥等,也用作表面活性劑,熔點-54.1℃,沸點69.1℃,遇水發生劇烈水解.某學習小組用如圖裝置制備磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).
磺酰氯(SO2Cl2)用于有機合成、醫藥、染料、農藥等,也用作表面活性劑,熔點-54.1℃,沸點69.1℃,遇水發生劇烈水解.某學習小組用如圖裝置制備磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).分析 (1)濃鹽酸與二氧化錳為原料制取Cl2,反應生成氯化鎂、氯氣和水;
(2)B為冷凝管,冷凝回流,燒杯中堿液可吸收尾氣;
(3)利用微熱法檢驗氣密性;反應為放熱反應,結合平衡移動分析;
(4)SO2Cl2與H2O反應屬于非氧化還原反應,則生成硫酸根離子和氯離子,結合離子檢驗方法解答.
解答 解:(1)用濃鹽酸與二氧化錳為原料制取Cl2,反應的化學方程式為MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B為冷凝管,儀器B的作用是冷凝SO2Cl2(或使揮發的產物SO2Cl2冷凝).燒杯中盛放的溶液為NaOH,可吸收尾氣,
故答案為:冷凝SO2Cl2(或使揮發的產物SO2Cl2冷凝); NaOH;
(3)檢驗裝置氣密性的方法為關閉旋塞K1和K2,將導管出口置于水槽中,在三頸燒瓶底部加熱,若導管口有氣泡,移開酒精燈后能形成一段水柱,說明氣密性良好;
制備過程中需采用冰水浴,從化學反應原理角度可知生成SO2Cl2為放熱反應,低溫有利于反應向正反應方向進行,
故答案為:關閉旋塞K1和K2,將導管出口置于水槽中,在三頸燒瓶底部加熱,若導管口有氣泡,移開酒精燈后能形成一段水柱,說明氣密性良好;生成SO2Cl2為放熱反應,低溫有利于反應向正反應方向進行;
(4)SO2Cl2與H2O反應屬于非氧化還原反應,則生成硫酸根離子和氯離子,離子檢驗方法為取少量W溶液于試管中,加入過量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀產生,說明溶液中含有SO42?,過濾,向濾液中滴加HNO3酸化,再加入AgNO3溶液,產生白色沉淀,則說明溶液中有Cl?,
故答案為:取少量W溶液于試管中,加入過量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀產生,說明溶液中含有SO42?,過濾,向濾液中滴加HNO3酸化,再加入AgNO3溶液,產生白色沉淀,則說明溶液中有Cl?.
點評 本題考查制備實驗及性質實驗,為高頻考點,把握物質的性質、發生的反應、實驗裝置的作用為解答的關鍵,側重分析與實驗能力的考查,注意實驗操作及離子檢驗,題目難度中等.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知25℃時部分弱電解質的電離平衡常數數據如表所示:
已知25℃時部分弱電解質的電離平衡常數數據如表所示:| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平衡常數 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
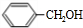 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
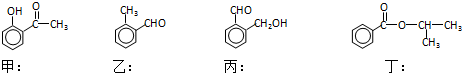
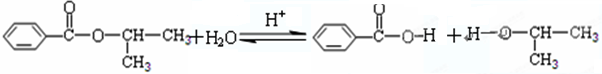 ;
;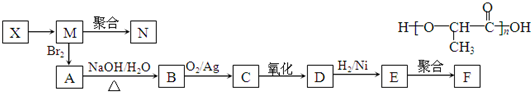
 .
.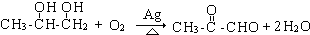 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中子數為20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子結構示意圖: | D. | Na2S的電子式 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
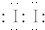 (用電子式表示).
(用電子式表示).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com