
 O2(g)?SO3(g)+98kJ
O2(g)?SO3(g)+98kJ ,若在此溫度下,向100L的恒容密閉容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),則反應開始時v(正)______v(逆)(填“<”、“>”或“=”).
,若在此溫度下,向100L的恒容密閉容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),則反應開始時v(正)______v(逆)(填“<”、“>”或“=”).
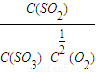 =2.5>K,所以化學反應正向進行,即v(正)>v(逆),故答案為:>;
=2.5>K,所以化學反應正向進行,即v(正)>v(逆),故答案為:>;  O2(g)?SO3(g)
O2(g)?SO3(g) a a
a a  a a
a a  a)+a=0.48
a)+a=0.48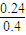 ×100%=60%,故答案為:60%;
×100%=60%,故答案為:60%; 

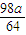
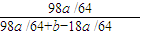 ×100%=50%,
×100%=50%,

 小天才課時作業系列答案
小天才課時作業系列答案 一課四練系列答案
一課四練系列答案 黃岡小狀元滿分沖刺微測驗系列答案
黃岡小狀元滿分沖刺微測驗系列答案 新輔教導學系列答案
新輔教導學系列答案 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源: 題型:閱讀理解
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
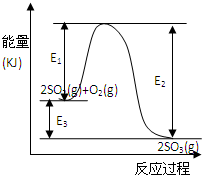 利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟.T℃時反應2SO2(g)+O2(g)?2SO3(g)過程中的能量變化如圖所示,回答下列問題.
利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟.T℃時反應2SO2(g)+O2(g)?2SO3(g)過程中的能量變化如圖所示,回答下列問題.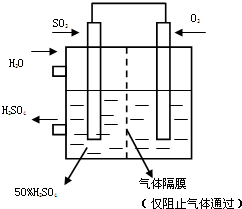
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解


| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:
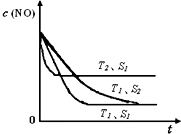 氮氧化物是大氣污染物之一,消除氮氧化物的方法有多種.
氮氧化物是大氣污染物之一,消除氮氧化物的方法有多種.| 180℃ |
| 催化劑 |
| ClO2 |
| 反應Ⅰ |
| Na2SO3 |
| 反應Ⅱ |
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)已知1.0mol·L—1NaHSO3溶液的pH為3.5,則此溶液離子濃度從大到小的順序為 (用離子符號表示)。
 (2)能證明Na2SO3溶液中存在水解平衡SO32-+H2O
(2)能證明Na2SO3溶液中存在水解平衡SO32-+H2O![]() HSO3-+OH-的事實是 (填序號)。
HSO3-+OH-的事實是 (填序號)。
A.滴入酚酞溶液變紅,再加入H2SO4溶液紅色退去
B.滴入酚酞溶液變紅,再加入氯水后紅色退去
C.滴入酚酞溶液變紅,在加入BaCl2溶液后產生沉淀且紅色退去
(3)工業上利用催化氧化反應將SO2轉化為SO3:2SO2+ O2 ![]() 2SO3。若某溫度下,此反應的起始濃度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,達到平衡后,SO2的轉化率為50%,則此溫度下該反應的平衡常數K= 。
2SO3。若某溫度下,此反應的起始濃度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,達到平衡后,SO2的轉化率為50%,則此溫度下該反應的平衡常數K= 。
(4)在酸性溶液中,碘酸鉀(KIO3)和亞硫酸鈉可發生如下反應:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液檢驗,根據反應溶液出現藍色所需的時間來衡量該反應的速率。某同學設計實驗如下表所示:
| 0.01mol·L-1 KIO3 酸性溶液(含淀粉)的體積/mL | 0.01mol·L-1 Na2SO3 溶液的體積/mL | H2O的體積 /mL | 實驗 溫度 /℃ | 溶液出現藍色時所需時間/s | |
| 實驗1 | 5 | V1 | 35 | 25 | |
| 實驗2 | 5 | 5 | 40 | 25 | |
| 實驗3 | 5 | 5 | V2 | 0 |
表中V2=___________mL,該實驗的目的是______________ ______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com