
| 化學鍵 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 實驗編號 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

分析 (1)化學上,規定標準狀況下穩定單質的生成熱為0.幾種物質的生成熱:NH3(g)為mkJ•mol-1,H2O(l)為nkJ•mol-1,反應的△H=產物的生成熱之和-反應物的生成熱之和,反應焓變△H=反應物總鍵能-生成物總鍵能;
(2)①根據放出的熱量計算消耗二氧化硫物質的量,再根據v=$\frac{△c}{△t}$計算v(SO2);
②平衡時NO為a mol,表示出參加反應二氧化氮的物質的量,進而計算二氧化氮的轉化率;
③再計算乙實驗平衡常數,結合甲中平衡常數判斷溫度高低;
(3)N2O4(g)═2NO2(g)△H=+57kJ•mol-1,該反應為吸熱反應,升高溫度,化學平衡正向移動,NO2的體積分數增大;增大壓強,化學平衡逆向移動,NO2的體積分數減小,結合圖象來分析解答.
a、A、C兩點都在等溫線上,壓強越大,反應速率越快;
b、增大壓強平衡向逆反應進行,向逆反應進行是減小由于壓強增大導致濃度增大趨勢,但到達平衡仍比原平衡濃度大;
c、壓強相同,升高溫度,化學平衡正向移動,NO2的體積分數增大,A點NO2的體積分數大;
d、平衡常數隨溫度變化,據此判斷;
(4)根據發生的電極反應,可以知道金屬鐵是陰極,石墨電極是陽極,根據電解質中離子的放電順序以及電極反應和電子的轉移知識來回答即可;
解答 解:(1)2N2(g)+6H2O(l)═4NH3(g)+3O2(g),規定標準狀況下穩定單質的生成熱為0.幾種物質的生成熱:NH3(g)為mkJ•mol-1,H2O(l)為nkJ•mol-1,反應的△H=產物的生成熱之和-反應物的生成熱之和=(4m-6n)KJ/mol,
(4m-6n)KJ/mol=(2a+12b-12d-3c)KJ/mol,
H-N鍵的鍵能為d=$\frac{2a+12b-3c-4m+6n}{12}$,
故答案為:4m-6n; $\frac{2a+12b-3c-4m+6n}{12}$;
(2)①實驗甲中,若2min時測得放出的熱量是4.2kJ,則消耗二氧化硫物質的量為$\frac{4.2KJ}{42KJ/mol}$=0.1mol,則v(SO2)=$\frac{\frac{0.1mol}{1L}}{2min}$=0.05mol/(L.min);
故答案為:0.05mol/(L.min);
②實驗丙中,平衡時NO為a mol,則參加反應二氧化氮的物質的量為amol,
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):0.2 0.3 0 0
變化量(mol):a a a a
平衡量(mol):0.2-a 0.3-a a a
故二氧化氮的轉化率為$\frac{amol}{0.3mol}$×100%=$\frac{10a}{3}$×100%,
故答案為:$\frac{10a}{3}$×100%;
③乙實驗平衡時,NO為0.16mol,則:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):0.2 0.8 0 0
變化量(mol):0.16 0.16 0.16 0.16
平衡量(mol):0.04 0.64 0.16 0.16
T2溫度下平衡常數K=$\frac{c(S{O}_{3})c(NO)}{c(S{O}_{2})c(N{O}_{2})}$=$\frac{0.16×0.16}{0.04×0.64}$=1,
正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,故T1<T2,
故答案為:<;
(3)a.由圖象可知,A、C兩點都在等溫線上,C的壓強大,則A、C兩點的反應速率:A<C,故a錯誤;
b.由圖象可知,A、C兩點都在等溫線上,C的壓強大,與A相比C點平衡向逆反應進行,向逆反應進行是由于減小體積增大壓強,平衡移動的結果降低NO2濃度增大趨勢,但到達平衡仍比原平衡濃度大,平衡時NO2濃度比A的濃度高,NO2為紅棕色氣體,則A、C兩點氣體的顏色:A淺,C深,故b錯誤;
c.升高溫度,化學平衡正向移動,NO2的體積分數增大,由圖象可知,A點NO2的體積分數大,則T1<T2,由狀態A到狀態B,可以用降溫的方法,故c錯誤;
d.由圖象可知,A、C兩點都在等溫線上,溫度不變平衡常數不變,A、C兩點的化學平衡常數:A=C,故d正確;
故選d,
故答案為:d;
(4)①根據發生的電極反應,可以知道金屬鐵是陰極,接電源的負極,故答案為:負極;
②據氧化還原反應的原理,其反應方程式為3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,故答案為:N2;
③陰極上氫離子放電發生還原反應,生成氫氣,陽極發生氧化反應,陽極的電極反應式為:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑,
故答案為:CN--2e-+2OH-=CNO-+H2O;
點評 本題考查化學平衡計算與影響因素、反應速率、平衡常數、化學平衡圖象等,明確外界條件對化學平衡的影響及圖象中縱橫坐標的含義、“定一議二”“先拐先平”原則即可解答,側重考查學生分析計算能力,注意對平衡常數的理解掌握,難度中等.


科目:高中化學 來源: 題型:解答題
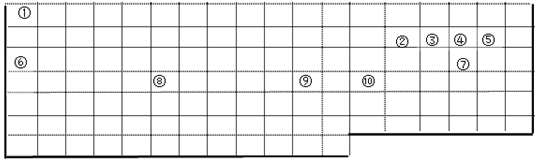

 .
.查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
下列實驗方法或裝置正確的是( )

A. 用圖1所示裝置制取乙烯
B. 用圖2所示方法驗證HCl氣體易溶于水
C. 用圖3所示方法探究固體表面積對反應速率的影響
D. 用圖4所示方法檢驗溴乙烷與NaOH醇溶液共熱產生乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙苯催化脫氫生產苯乙烯的反應:
乙苯催化脫氫生產苯乙烯的反應: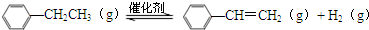
化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 時間/min | 0 | 10 | 20 | 30 | 40 |
| 總壓強/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 此反應在任何溫度下都能自發進行 | |
| B. | 此反應僅在低溫下自發進行 | |
| C. | 此反應僅在高溫下自發進行 | |
| D. | 此反應在任何溫度下都不能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com