
【題目】A、B、C、X是中學化學中常見的物質。在一定條件下,它們之間的轉化關系如下圖所示(部分產(chǎn)物已略去)。
![]()
回答下列問題:
(1)若X是空氣的主要成分之一,則A不可能是_____(填代號)。
a.Na b.C c.S d.Al
(2)若A常用作制冷劑,C為紅棕色氣體。寫出由A生成B的化學方程式___________。
(3)若C可用于治療胃酸過多,X是一種常見的溫室氣體。
①鑒別等濃度的B溶液和C溶液,可選用的試劑為______________(填化學式)。
②將A、B、C三種溶液混合,向45mL混合液中逐滴加入一定濃度的鹽酸,生成氣體的體積(標準狀況)與加入鹽酸的體積關系如下圖所示。
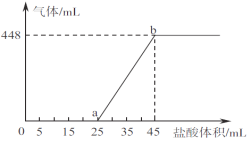
寫出ab段所發(fā)生反應的離子方程式__________________________;b點對應溶液中溶質的物質的量濃度為___________(忽路溶液體積變化)。
【答案】d4NH3+5O2![]() 4NO+6H2OHCl或H2SO4或HNO3或BaCl2或CaCl2HCO3-+H+=H2O+CO2↑0.5 mol·L-1
4NO+6H2OHCl或H2SO4或HNO3或BaCl2或CaCl2HCO3-+H+=H2O+CO2↑0.5 mol·L-1
【解析】
由反應的轉化關系可以知道A可與X連續(xù)反應,如A為金屬,應為變價金屬,如X為氧氣,則A可為變價非金屬或Na,圖中轉化關系可符合鋁三角的轉化,或為多元弱酸對應的鹽,
詳解: (1)若X是O2,則A不可能是Al,故答案選:d;
(2) 若A常用作制冷劑,C為紅棕色氣體,則A為NH3,B為NO,C為NO2,X為O2,所以由A生成B的化學方程式:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
因此,本題正確答案是:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3) 若C可用于治療胃酸過多,X是一種常見的溫室氣體,則X為CO2,A為NaOH,B為Na2CO3, C為NaHCO3,
①鑒別等濃度的Na2CO3溶液和NaHCO3溶液,可選用的試劑為HCl或H2SO4或HNO3或BaCl2或CaCl2
因此,本題正確答案是:HCl或H2SO4或HNO3或BaCl2或CaCl2;
②假設混合后的溶液中只有Na2CO3,向混合溶液中滴加鹽酸,開始發(fā)生反應:Na2CO3+HCl= NaHCO3+NaCl,然后發(fā)生反應:NaHCO3+HCl= NaCl+H2O+CO2↑,前后2階段消耗鹽酸的體積相等,而實際中生成二氧化碳消耗鹽酸較少,說明Oa段發(fā)生:NaOH+HCl=NaCl+H2O,Na2CO3+HCl= NaHCO3+NaCl,而ab段發(fā)生:NaHCO3+HCl= NaCl+H2O+CO2↑,則: ab段所發(fā)生反應的離子方程式HCO3-+H+=H2O+CO2↑,
因此,本題正確答案是為:HCO3-+H+=H2O+CO2↑;
ab段發(fā)生:NaHCO3+HCl= NaCl+H2O+CO2↑,所以二氧化碳的物質的量就是的鹽酸的物質的量,根據(jù)c=![]() =1mol/L,
=1mol/L,
b點對應溶液中溶質為NaCl,根據(jù)氯元素守恒,NaCl的物質的量等于加入的HCl的物質的量,n=1mol/L×0.045L=0.045mol,所以NaCl的物質的量濃度為:![]() 0.5mol/L,
0.5mol/L,
因此,本題正確答案是:0.5 mol·L-1。


科目:高中化學 來源: 題型:
【題目】下列各組中的離子,能在溶液中大量共存的是( )
A.Mg2+、H+、C1-、OH-B.K+、Ca2+、NO3-、CO32-
C.Mg2+、Na+、SO42-、Cl-D.Na+、H+、CO32-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏伽德羅常數(shù),下列說法中正確的是( ) ①常溫常壓下,17g甲基(﹣14CH3)所含的中子數(shù)為9NA
②常溫常壓下,22.4L NO氣體的分子數(shù)小于NA
③室溫下,28.0g乙烯和丙烯的混合氣體中含有的共價鍵約為3×6.02×1023個
④7.2g CaO2中含有的陰離子數(shù)目約為6.02×1022
⑤標準狀況時,22.4L氟化氫所含有的原子數(shù)為2NA
⑥標況下,7.8g苯中含有碳碳雙鍵的數(shù)目為0.3NA .
A.①②⑥
B.②④⑤
C.②④
D.⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在容積為2 L的密團容器中進行某一反應,容器內M、N兩種氣體的物質的量隨時間的變化曲線如圖所示。據(jù)圖可知

A. 該反應的化學方程式為N(g) ![]() 2M(g) B. t1~t2時間內,v(M)=(1/t2-t1) mol·L-1·min-1
2M(g) B. t1~t2時間內,v(M)=(1/t2-t1) mol·L-1·min-1
C. t2時,正逆反應速率相等,反應達平衡狀態(tài) D. 平衡時,物質N的轉化率為75%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述與圖象對應符合的是( ) 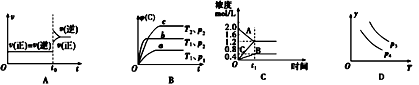
A.對于達到平衡狀態(tài)的N2(g)+3H2(g)2NH3 (g)在t0時刻充入了一定量的NH3 , 平衡逆向移動
B.對于反應 2A(g)+B(g)C(g)+D(g)△H<0,p2>p1 , T1>T2
C.該圖象表示的化學方程式為:2A═B+3C
D.對于反應 2X(g)+3Y(g)2Z(g)△H<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按下列要求作答.
(1)宇宙中含量最高的元素為(填元素符號).
(2)第四周期中第一電離能最小的元素的最高價氧化物的水化物的電子式為 .
(3)電負性最大的元素的原子核外電子排布式為 .
(4)第二周期中,第一電離能介于B和N之間的元素共有種.
(5)最外層電子排布為4s24p1的原子的核電荷數(shù)為
(6)前36號元素中,未成對電子數(shù)最多的元素在周期表中的位置為 , 它位于 區(qū).
(7)地球上的元素絕大多數(shù)是金屬,非金屬 (包括稀有氣體)僅應 種.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以有機物A合成聚酯類高分子化合物F的路線如下圖所示:

已知:RCH=CH3 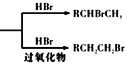
(1)A、C中含氧官能團的名稱分別為_______,A生成B的反應類型為_________。
(2)D與NaOH水溶液反應的化學方程式為_________________________________。
(3)①E生成F的化學方程式為_____________________________________________。
②若F的平均相對分子質量為20000,則其平均聚合度為_____(填字母代號)。
A.54 B.108 C.119 D.133
(4)E在一定條件下還可以合成含有六元環(huán)結構的G,則G的結構簡式為____________。
(5)滿足下列條件的C的同分異構體有____種(不考慮立體異構)。
①含有1個六元碳環(huán),且環(huán)上相鄰4個碳原子上各連有一個取代基
②1mol該物質與新制氫氧化銅懸濁液反應產(chǎn)生2mol磚紅色沉淀
(6)寫出以![]() 為原料(其他試劑任選)制備化合物
為原料(其他試劑任選)制備化合物![]() 的合成路線,請用以下方式表示:
的合成路線,請用以下方式表示: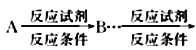 目標產(chǎn)物。__________________
目標產(chǎn)物。__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】針對下面四套實驗裝置圖,下列說法正確的是

A. 圖1裝置犧牲鎂保護鐵
B. 用圖2裝置鐵釘發(fā)生吸氧腐蝕腐蝕導致試管中水面上升
C. 圖3裝置中Mg作負極,Al作正極
D. 用圖4裝置對二次電池進行充電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫能是一種理想的“綠色能源”,以下有關氫能開發(fā)的方式中最理想的是( )
A.大量建設水電站,用電力分解制取氫氣
B.利用化石燃料燃燒放熱,高溫分解水產(chǎn)生氫氣
C.在催化劑作用下,利用太陽能分解水
D.利用鐵等金屬與酸反應產(chǎn)生氫氣
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com