
A、B、C三種物質中均含有同一種元素M,它們之間有如下圖所示的轉化關系,(部分反應物質已略去)。A為一種金屬單質,反應①②③均為化合反應,反應④為置換反應。下列有關說法正確的是
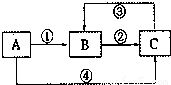
A.①中所加試劑只能是Cl2
B.③中需要加具有還原性的試劑
C.A與稀硝酸反應一定能實現元素M 在①中發生的價態變化
D.元素M在②中發生的價態變化也能通過加KI溶液實現
科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
25℃時,在20 ml 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲線如圖所示,有關粒子濃度的關系中,不正確的是( )
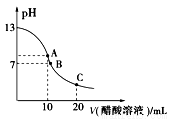
A.在A點:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在 B點:c(Na+)﹦c(CH3
B點:c(Na+)﹦c(CH3 COO-)﹥c(OH-)﹦c(H+)
COO-)﹥c(OH-)﹦c(H+)
C.在C點:c(CH3COO-)﹥c(Na+)﹥c(H+)﹥c(OH-)
D.在C點:c(CH3COO-)+c(CH3COOH)﹦2c(Na+)
查看答案和解析>>
科目:高中化學 來源:2017屆山東省日照市高三上學期期中化學試卷(解析版) 題型:選擇題
合成氨及其相關工業中,部分物質間的轉化關系如下:
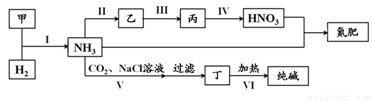
下列說法不正確的是( )
A.反應Ⅱ、III和Ⅳ的氧化劑一定相同
B.甲、乙、丙三種物質中都含有氮元素
C.反應Ⅵ的部分產物可在上述流程中循環利用
D. 反應V的化學方程式為NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
反應V的化學方程式為NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上學期第三次月考化學試卷(解析版) 題型:選擇題
中學常見物質A、B、C、D、E、X,存在下圖轉化關系 (部分生成物和反應條件略去)。下列推斷不正確的是( )
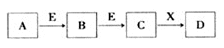
A.若D是一種白色沉淀,在空氣中最終變為紅褐色,則A可能是鐵
B.若D是一種強堿,則A、B、C均可與X反應生成D
C.若D為NaCl,且A可與C反應生成B,則E可能是CO2
D.若D是一種強酸,則A既可以是單質,也可以是化合物,且D可與銅反應生成B或 C
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第三次周考化學卷(解析版) 題型:實驗題
甲同學進行Fe2+還原性的實驗,針對異常現象進行探究。
步驟一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量鐵粉振蕩,靜置后取上層清液,測得pH<1。
實驗二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,無現象;再滴加5滴5% H2O2溶液(物質的量濃度約為1.5mol·L-1、pH約為5),觀察到溶液變紅,大約10秒左右紅色褪去,有氣體生成(經檢驗為O2).
(1)用離子方程式表示步驟二中溶液變紅的原因:________________。
(2)甲探究步驟二中溶液褪色的原因:
Ⅰ.取褪色后溶液兩份,一份滴加FeCl3溶液無現象;另一份滴加KSCN溶液出現紅色;
Ⅱ.取褪色后溶液,滴加鹽酸和BaCl2溶液,產生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,變紅,通入O2,無明顯變化。
①實驗I的說明__________________;
②實驗Ⅲ的目的是____________________。
得出結論:溶液褪色的原因是酸性條件下H2O2將SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重復步驟二中的操作,發現液體紅色并未褪去,進一步探究其原因:
②.用激光筆分別照射紅色液體和滴加了KSCN溶液的FeCl3溶液,前者有丁達爾效應,后者無.測所配FeCl2溶液的pH約為3.由此,乙認為紅色不褪去的可能原因是:____________________。
③.查閱資料后推測,紅色不褪去的原因還可能是pH較大時H2O2不能氧化SCN-.乙利用上述部分試劑,通過實驗排除了這一可能.乙的實驗操作及現象是:
步驟 | 試劑及操作 | 現 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上11月月考化學卷(解析版) 題型:填空題
下圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,電極均為石墨電極。
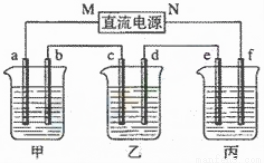
(1)接通電源,經過一段時間后,測得丙中K2SO4濃度為10.47%,乙中c電極質量增加。據此回答問題:
① 電源的N端為______________極;
② 電極b上發生的電極反應為_______________;
③ 列式計算電極b上生成的氣體在標準狀況下的體積_____________(保留小數點后一位);
④ 電極c的質量變化是____________g;
⑤ 電解前后各溶 液的PH變化(填“增大”、“減小”、“不變”),簡述其原因:
液的PH變化(填“增大”、“減小”、“不變”),簡述其原因:
甲溶液______________________;
乙溶液______________________;
丙溶液______________________;
(2)如果電解過程中銅全部析出,此時電解能否繼續進行,為什么?
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上11月月考化學卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數,下列說法中正確的是
A.常溫常壓下22.4L的CO2在一定條件下與足量的鎂反應,轉移4NA個電子
B.60g SiO2中含硅氧鍵數目為4NA
C.1.00mol NaCl中含有6.02×1023個NaCl分子
D.3.9gNa2O2中所含的陰離子數目為0.1NA
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:填空題
試回答下列問題:
(1)寫出在酸性條件下H2O2氧化氯化亞鐵的離子反應方程式:_____________。
(2)日常生活中常用的“84消毒液”的主要成分是NaClO,而潔廁靈的主要成分是HCl,兩者不能混合使用,請用離子方程式表示原因_______________________。
(3)取300 mL 0.2 mol/L KI溶液與一定量的酸性KMnO4溶液恰好完全反應,生成等物質量的I2和KIO3,則消耗KMnO4的物質的量為________mol
(4) 在Na2S2O3的溶液中加入稀硫酸石到的現象是:______________,寫出該反應的離子方程式_________________。
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列與NA有關的說法正確的是
A.在反應KClO3+6HCl=KCl+3Cl2↑+3H2O中,當得到標準狀況下67.2 L Cl2時,反應中轉移的電子數為6 NA
B.6.0 g SiO2晶體中含有的硅氧鍵數目為0.2 NA
C.標準狀況下,22.4 L NO和11.2 L O2混合后氣體的分子總數為NA
D.S2和S8的混合物共6.4 g,其中所含硫原子數一定為0.2 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com