
芳香化合物A是一種基本化工原料,可以從煤和石油中得到。OPA是一種重要的有機化工中間體.A、B、C、D、E、F和OPA的轉化關系如下所示:
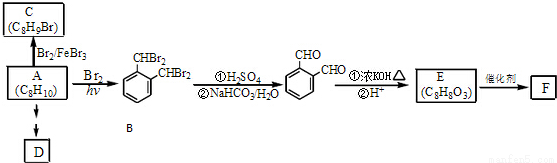
回答下列問題:
(1)A的化學名稱是____________;
(2)由A生成B 的反應類型是____________,在該反應的副產物中,與B互為同分異構體的化合物的結構簡式為____________;
(3)寫出C所有可能的結構簡式____________;
(4)D(鄰苯二甲酸二乙酯)是一種增塑劑.請用A、不超過兩個碳的有機物及合適的無機試劑為原料,經兩步反應合成D。用結構簡式表示合成路線____________;
(5)OPA的化學名稱是____________,OPA經中間體E可合成一種聚酯類高分子化合物F,由E合成F的反應類型為____________,該反應的化學方程式為____________;(提示 )
)
(6)芳香化合物G是E的同分異構體,G分子中含有醛基、酯基和醚基三種含氧官能團,寫出G所有可能的結構簡式____________。
 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源:2016屆海南中學高三考前高考模擬十化學試卷(解析版) 題型:填空題
碘化鈉在醫藥中用作甲狀腺腫瘤防治劑、祛痰劑和利尿劑,也用作食品添加劑、感光劑等。 工業上用NaOH溶液、水合肼制取碘化鈉固體,其制備流程圖如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成過程的反應產物中含有NaIO3,則在合成過程中消耗了3 mol I2,所生成 NaIO3的物質的量為 mol。
(2)寫出還原過程中的離子方程式 ;在還原過程中,為了加快反應,可采取可提高反應溫度,但溫度不得超過 ℃;請選擇下列試劑檢測所得碘化鈉固體中是否含有NaIO3雜質 (選填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)測定產品中NaI含量的實驗步驟如下:
a.稱取4.000g 樣品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待測液于錐形瓶中,然后加入足量的FeCl3溶液,充分反應后,再加入A溶液作指示劑;
c.用 0.1000mol·L -1 的Na2S2O3,溶液進行滴定至終點(發生反應的方程式為:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重復測定2次,所得的相關數據如下表:
測定 序號 | 待測液體積/ mL | 標準液滴定管起點讀數/ mL | 標準液滴定管終點讀數/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液時所發生的離子方程式為 。
②加入A物質為 (填名稱);滴定終點觀察到的現象為 。
③計算該樣品中NaI的含量為 。
(只寫出有具體數值的表達式即可)
(4)碘化鈉固體的保存方法是 。
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三考前預測化學試卷(解析版) 題型:填空題
仔細分析如圖裝置,完成下面的填空:
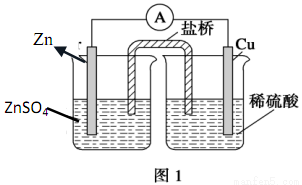
(1)該反應的電流方向是_____________。
(2)鹽橋中的陰離子向________溶液中移動。
(3)一段時間后,鋅片上的現象是_____________,銅片上的現象是______________。
(4)鋅極發生_________反應,總反應方程式為_________________。
(5)30min后,1.3g的Zn參加了反應,則轉移了_______個電子。
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三第八次月考理綜化學試卷(解析版) 題型:填空題
根據碳、鈣、銅等元素的單質及其化合物的結構和性質,請回答下列問題:
(1)實驗室用CaC2與水反應生成乙炔:
①①將乙炔通入[Cu(NH3)2]Cl溶液中反應生成紅棕色Cu2C2沉淀,Cu+基態核外電子排布式為__________。其在酸性溶液中不穩定,可發生歧化反應生成Cu2+和Cu,但CuO在高溫下會分解成Cu20,試從結構角度解釋高溫下CuO何會生成Cu2O:__________。
②CaC2中C22-與O22+互為等電子體,0.5molO22+中含有的π鍵數目為__________;
③乙炔與氫氰酸反應可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子軌道雜化類型是__________,構成丙烯腈的元素中第一電離能最大的是__________。
(2)①銅元素的醋酸鹽晶體局部結構如圖甲,該晶體中含有的化學鍵是__________(填選項序號)
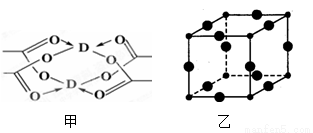
A.極性鍵 B.非極性鍵 C.配位鍵 D.金屬鍵
②Cu3N的晶胞結構如圖乙,N3-的配位數為__________ ,Cu+半徑為acm,N3-半徑為bcm,Cu3N的密度為__________ g•cm-3.(阿伏加德羅常數用NA表示)。
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三第八次月考理綜化學試卷(解析版) 題型:選擇題
下列實驗的操作、現象和結論均正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 苯酚水溶液與Na2CO3溶液混合 | 溶液變澄清 | 結合H+的能力:CO32->C6H5O- |
B | 將FeSO4高溫強熱,得紅色固體,產生的氣體全部通入足量BaCl2溶液 | 產生白色沉淀 | 白色沉淀為BaSO4和BaSO3 |
C | 將淀粉與少量稀硫酸加熱一段時間后,再加入銀氨溶液 | 未析出銀鏡 | 淀粉沒有水解 |
D | 2mL1mol/L的NaOH溶液中滴加2滴0.1mol/L MgCl2溶液、再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀,后有紅褐色沉淀 | Ksp[Mg(OH )2]>Ksp[Fe(OH)3] |
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三5月高考模擬理綜化學試卷(解析版) 題型:填空題
1913年,德國化學家哈伯實現了合成氨的工業化生產,被稱作解救世界糧食危機的化學天才.現將lmolN2和3molH2投入1L的密閉容器,在一定條件下,利用如下反應模擬哈伯合成氨的工業化生產:N2(g)+3H2(g) 2NH3(g)△H<0.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.
2NH3(g)△H<0.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.

回答下列問題:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g) 2NH3(l)△H2;則反應N2(g)+3H2(g)
2NH3(l)△H2;則反應N2(g)+3H2(g) 2NH3(g)的△H=_____________(用含△H1、△H2的代數式表示)。
2NH3(g)的△H=_____________(用含△H1、△H2的代數式表示)。
(2)合成氨的平衡常數表達式為____________,平衡時,M點NH3的體積分數為10%,則N2的轉化率為____________(保留兩位有效數字).
(3)X軸上a點的數值比b點____________(填“大”或“小”)。上圖中,Y軸表示____________(填“溫度”或“壓強”),判斷的理由是____________。
(4)若將1mol N2和3mol H2分別投入起始容積為1L的密閉容器中,實驗條件和平衡時的相關數據如表所示:
容器編號 | 實驗條件 | 平衡時反應中的能量變化 |
Ⅰ | 恒溫恒容 | 放熱Q1kJ |
Ⅱ | 恒溫恒壓 | 放熱Q2kJ |
Ⅲ | 恒容絕熱 | 放熱Q3kJ |
下列判斷正確的是____________
A.放出熱量:Ql<Q2<△Hl
B.N2的轉化率:Ⅰ>Ⅲ
C.平衡常數:Ⅱ>Ⅰ
D.達平衡時氨氣的體積分數:Ⅰ>Ⅱ
(5)常溫下,向VmL amoI.L-l的稀硫酸溶液中滴加等體積bmol.L-l的氨水,恰好使混合溶液呈中性,此時溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”).
(6)利用氨氣設計一種環保燃料電池,一極通入氨氣,另一極通入空氣,電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,它在熔融狀態下能傳導O2-.寫出負極的電極反應式____________。
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三5月高考模擬理綜化學試卷(解析版) 題型:選擇題
化學與環境、材料、信息、能源關系密切,下列說法正確的是( )
A.綠色化學的核心是應用化學原理對環境污染進行治理
B.開發高效氫能、太陽能等新型電動汽車,以解決城市機動車尾氣排放問題
C.PM 2.5是指大氣中直徑接近2.5×10-6m的顆粒物,分散在空氣中形成膠體
D.半導體行業中有一句話:“從沙灘到用戶”,計算機芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:選擇題
如圖所示的實驗,能達到實驗目的是( )
A | B | C | D |
|
|
|
|
驗證化學能轉化為電能 | 驗證溫度對平衡移動的影響 | 驗證鐵發生氫腐蝕 | 驗證非金屬Cl>C>Si |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省高二下期中化學試卷(解析版) 題型:選擇題
精確測量金屬離子在惰性電極上以鍍層形式沉積的金屬質量,可以確定電解過程中通過電解池的電量。實際測量中常用的銀電量計結構如圖所示,則下列說法正確的是( )
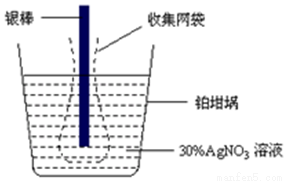
A.電量計中的銀棒應與電源的正極相連,鉑坩堝上發生的電極反應式為:2H++NO3-+e-= NO2↑+H2O
B.已知每摩爾電子的電量為96 500 C,若反應進行10分鐘,稱量電解前后鉑坩堝的質量變化值為108.0 mg,則電解過程中的平均電流約為9.65A
C.若要測定電解精煉銅時通過的電量,可將銀電量計中的銀棒與待測電解池的精銅電極相連
D.實驗中,為了避免銀溶解過程中可能產生的金屬顆粒掉進鉑坩堝而導致測量誤差,常在銀電極附近增加一個收集網袋。若沒有收集網袋,測量結果會偏低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com