
【題目】利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污泥中Cr(III)的處理工藝流程如下:

其中硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)實驗室用18.4mol·L-1的濃硫酸配制250mL 4.8 mol·L-1的硫酸溶液,需量取濃硫酸___________mL;配制時所用玻璃儀器除量筒、燒杯和玻璃棒外,還需_________。
(2)酸浸時,為了提高浸取率可采取的措施有____________________________。(答出兩點)。
(3)H2O2的作用是將濾液I中的Cr3+轉化為Cr2O72-,寫出此反應的離子方程式:______________。
(4)常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
開始沉淀時的pH | 2.7 | — | — | — |
沉淀完全時的pH | 3.7 | 11.1 | 5.4 (>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈堿性,Cr2O72-轉化為CrO42-.濾液Ⅱ中陽離子主要有_________;但溶液的pH不能超過8,其理由是_______________________。
(5)鈉離子交換樹脂的反應原理為:Mn++nNaR→MRn+nNa+,利用鈉離子交換樹脂除去濾液Ⅱ中的金屬陽離子是__________________。
(6)寫出上述流程中用SO2進行還原時發生反應的化學方程式:______________________ 。
【答案】 65 250mL容量瓶、膠頭滴管 升高溫度(加熱)、攪拌等 2Cr3++ 3H2O2+ H2O =Cr2O72-+ 8H+ Ca2+、Mg2+ pH超過8會使部分Al(OH)3溶解生成AlO2-,最終影響Cr(III)回收與再利用 Ca2+、Mg2+ 3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH (3SO2+ 2CrO42-+ 12H2O=2CrOH(H2O)5SO4↓+ SO42-+ 2OH-)
【解析】(1)設需要的濃硫酸的體積為VmL,根據溶液稀釋定律C濃V濃=C稀V稀可知:18.4mol·L-1×VmL=250ml×4.8mol·L-1,解得V=65mL;配置一定物質的量濃度的溶液所需的玻璃儀器有:燒杯、玻璃棒、吸量管、容量瓶和膠頭滴管,故答案為:250mL容量瓶、膠頭滴管;(2)酸浸時,為了提高浸取率可采取的措施是:延長浸取時間、加快溶解速度等措施,故答案為:升高反應溫度;攪拌;增大固體顆粒的表面積;(3)雙氧水有強氧化性,能氧化還原性的物質,Cr3+有還原性,Cr3+能被雙氧水氧化為高價離子,以便于與雜質離子分離,故答案為:2Cr3++3H2O2+H2O=Cr2O72-+8H+;(4)硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入過氧化氫氧化鉻離子為Cr2O72-,加入NaOH溶液使溶液呈堿性,Cr2O72-轉化為CrO42-。溶液PH=8,Fe3+、Al3+沉淀完全,濾液Ⅱ中陽離子主要Na+、Ca2+和Mg2+;超過PH=8,氫氧化鋁是兩性氫氧化物會溶解于強堿溶液中影響鉻離子的回收利用;故答案為:Na+、Mg2+、Ca2+;pH超過8會使部分Al(OH)3溶解生成AlO2-,最終影響Cr(III)回收與再利用;(5)鈉離子交換樹脂交換的離子是鈣離子和鎂離子,故答案為:Ca2+、Mg2+;(6)二氧化硫具有還原性,被濾液Ⅱ中通過離子交換后的溶液中Na2CrO4氧化為硫酸,Na2CrO4氧被還原為CrOH(H2O)5SO4,水溶液中生成氫氧化鈉溶液和硫酸反應生成硫酸鈉,依據原子守恒分析書寫配平;33SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH (3SO2+ 2CrO42-+ 12H2O=2CrOH(H2O)5SO4↓+ SO42-+ 2OH-),故答案為:3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH (3SO2+ 2CrO42-+ 12H2O=2CrOH(H2O)5SO4↓+ SO42-+ 2OH-)。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是:
A.甲烷的標準燃燒熱為-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式表示為:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 Mpa下,將0.5 mol N2和1.5 mol H2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-38.6kJ·mol-1
2NH3(g)ΔH=-38.6kJ·mol-1
C.同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃條件的ΔH相同
D.HCl和NaOH反應的中和熱△H=﹣57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱△H=2×(﹣57.3)kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬元素的敘述不正確的是( )
A. 金屬元素的單質在反應中只能失去電子
B. 金屬元素的陽離子只具有氧化性
C. 同一金屬元素在不同化合物中的化合價可能相同
D. 金屬元素在化合物中一定顯正價
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去下列物質中的雜質(括號內是雜質)所用試劑不正確的是( )
A. CO2〔HCl〕:飽和碳酸鈉溶液 B. CO2〔SO2〕:用酸性KMnO4溶液
C. Cl2〔HCl〕:用飽和的NaCl溶液 D. NO〔NO2〕: 用水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物是形成酸雨的成因之一,與其他污染物在一定條件下能產生光化學煙霧,加大對氮氧化物的處理是環境治理的重要研究內容。
(1)NH3催化NOx是目前應用最廣泛的煙氣氮氧化物脫除技術。
已知.①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
則反應4NH3(g)+6NO(g)![]() N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
(2)科學家用活性炭還原法可以消除NO的污染,發生的反應為C(s)+2N0(g)![]() N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容積恒定為1L的密閉容器中反應,經過10min反應達到平衡,測得NO的物質的量為0.5mol。
N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容積恒定為1L的密閉容器中反應,經過10min反應達到平衡,測得NO的物質的量為0.5mol。
①10min內,平均反應速率v(N2)=______,在T℃時,該反應的平衡常數K=_______。
②能判斷該反應一定達到化學平衡狀態的依據是______(填標號)。
a.單位時間內生成2nmolNO的同時消耗nmolCO2
b.反應體系的溫度不再發生改變
c.恒容條件下,混合氣體的密度不再發生改變
d.恒溫恒容條件下,反應體系的壓強不再發生改變
(3)電化學住化凈化NO是一種新穎的處理氮氧化物的方法。原理如下圖,固體電解質起到傳導O2-的作用,則通入NO的電極反應式為________。

(4)已知:25℃時,HNO2的電離常數Ka=7.1×10-4,CH3COOH的電離常數K=1.8×10-5,實驗室時可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。②③
①已知溶液甲為濃度均為0.1mol· L-1,的NaNO3和NaNO2的混合溶液,溶液乙為0.1mol·L-1的CH3COONa溶液,則兩溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的順序為_______,能使溶液甲和溶液乙的pH相等的方法是_______(填標號)。
a.向溶液甲中加適量水 b. 向溶液甲中加適量NaOH
c.向溶液乙中加適量水 d. 向溶液乙中加適量NaOH
②25℃時,向0.1mol·L-1CH3COOH溶液中加入一定量的CH3COONa溶液,使溶液中c(CH3COOH):c(CH3COO-)=5:9,此時溶液pH=_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】治理氮氧化物(NOx)的污染是化學研究的重要課題之一。
I.NO能被灼熱的鐵粉還原為N2,同時生成FeO,利用下列裝置模擬該反應。

已知:①濃硝酸可氧化NO;②NaOH溶液能與NO2反應,不與NO反應。
(1)上述裝置接口的連接順序為a→__________(按氣流方向,用小寫字母表示)。
(2)裝置D的作用是___________________。
(3)裝置E中反應的化學方程式為___________________。
(4)打開分液漏斗活塞,燒瓶中觀察到的實驗現象有_____________________。
II.實驗室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。設計實驗驗證產物NaNO2既有氧化性又有還原性。
限選試劑:稀硫酸、KI-淀粉溶液、雙氧水、酸性KMnO4溶液
(5)取適量NaNO2溶液,加入_____________,觀察到_____________現象,證明其具有氧化性。
(6)參照(5),設計實驗證明NaNO2有還原性________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關銀鏡反應的說法中,正確的是( )
A. 配置銀氨溶液時氨水必須過量
B. 1 mol甲醛發生銀鏡反應最多生成2 molAg
C. 銀鏡反應通常采用水浴加熱
D. 鑄銀鏡反應后的試管一般采用濃硝酸洗滌
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是一種重要的基本化工原料,以它為原料還可以合成很多的化工產品。現有以下轉化:

(1)聚乙烯的結構簡式為 ;
(2)寫出以下反應的化學方程式和反應類型:
② ,反應類型是
③ ,反應類型是
(3)實驗室用如圖裝置制備乙酸乙酯:試管中碎瓷片的作用是 ;導管a的作用是導氣和 ;試管b內飽和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為苯和溴的取代反應的實驗裝置圖,其中A為由具支試管制成的反應容器,在其下端開了一個小孔,塞好石棉絨,再加入少量鐵屑粉。
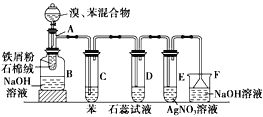
填寫下列空白:
(1)向反應容器A中逐滴加入溴和苯的混合液,幾秒鐘內就發生反應,寫出A中所發生反應的化學方程式(有機物寫結構簡式):_____________________,
(2)試管C中苯的作用是___________________________。反應開始后,觀察D和E兩試管,看到的現象為D中_________________,E中________________。
(3)反應2~3min后,在B中的NaOH溶液里可觀察到的現象是___________________。
(4)在上述整套裝置中,具有防倒吸作用的裝置有______________(填字母)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com