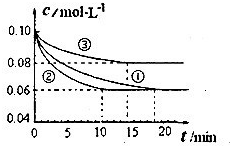
分析:(1)由圖可知,實驗②10min到達平衡,平衡時△(N
2)=0.1mol/L-0.06mol/L=0.04mol/L,再根據方程式計算△c(H
2)隨,根據v=
計算v(H
2);
由圖可知,與實驗①相比,實驗②到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗②應是使用催化劑;
由圖可知,與實驗①相比,實驗③到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,據此結合選項判斷;
(2)提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,結合平衡移動原理分析;
(3)NCl
3遇水發生水解反應,NCl
3分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,據此判斷雙鍵產物;
反應中只有氯元素的化合價發生變化,氯元素由NCl
3中+1降低為Cl
-中-1價,由ClO
2-中+3價升高為ClO
2中+4價,據此計算;
(4)溶液顯中性,所以c(H
+)=c(OH
-),溶液的電荷守恒可得:c(H
+)+c(NH
4+)=c(Cl
-)+c(OH
-),故c(NH
4+)=c(Cl
-),氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量;
電離常數只與溫度有關,結合電離常數K
b=
計算.
解答:解:(1)由圖可知,實驗②10min到達平衡,平衡時△(N
2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,△c(H
2)=3△(N
2)=3×0.04mol/L=0.12mol/L,故v(H
2)=
=0.012mol/(L?min),
由圖可知,與實驗①相比,實驗②到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗②應是使用催化劑,
由圖可知,與實驗①相比,實驗③到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,該反應正反應是體積減小的放熱反應,故為升高溫度;
故答案為:0.012mol/(L?min),e,c;
(2)提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,
a.該反應正反應是放熱反應,升高溫度,平衡向逆反應移動,氮氧化物的轉化率降低,故a錯誤;
b.該反應正反應是體積增大的反應,增大壓強,平衡向逆反應移動,氮氧化物的轉化率降低,故b錯誤;
c.增大NH
3的濃度,平衡向正反應移動,氮氧化物的轉化率增大,故c正確;
故答案為:c;
(3)NCl
3遇水發生水解反應,NCl
3分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,故生成NH
3的同時還得到HClO,
反應中只有氯元素的化合價發生變化,氯元素由NCl
3中+1降低為Cl
-中-1價,由ClO
2-中+3價升高為ClO
2中+4價,故轉移1mol電子,生成ClO
2的物質的量為1mol,質量為1mol×67.5g/mol=67.5g,
故答案為:HClO,67.5;
(4)溶液顯中性,所以c(H
+)=c(OH
-),溶液的電荷守恒可得:c(H
+)+c(NH
4+)=c(Cl
-)+c(OH
-),故c(NH
4+)=c(Cl
-),氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量,因為鹽酸和氨水的體積相等,則氨水的物質的量濃度大于鹽酸,
溶液中c(H
+)=c(OH
-)=10
-7mol/L,c(NH
4+)=c(Cl
-)=
mol/L,c(NH
3?H
2O)=(
-
)mol/L,
電離常數只與溫度有關,則此時NH
3?H
2O的電離常數K
b=
=
=
,
故答案為:>,
.

 (2013?煙臺一模)氮及其化合物在工農業生產中具有重要作用.
(2013?煙臺一模)氮及其化合物在工農業生產中具有重要作用.

 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案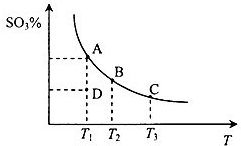 (2013?煙臺一模)二氧化硫的催化氧化原理為2SO2(g)+O2(g)?2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如圖所示.下列說法錯誤的是( )
(2013?煙臺一模)二氧化硫的催化氧化原理為2SO2(g)+O2(g)?2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如圖所示.下列說法錯誤的是( )