
【題目】研究電解質在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的電離常數如下表:
化學式 | HF | H2CO3 | H2S |
電離平衡常數K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常溫下,pH相同的三種溶液NaF、Na2CO3、Na2S,物質的量濃度最大的是____。
②將過量H2S通入Na2CO3溶液,反應的離子方程式是____。
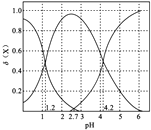
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物質的量分數δ(X)隨pH的變化如圖所示。則H2A的電離平衡常數K1=____。
(3)室溫下,用0.100 mol·L-1鹽酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲線如圖所示。(忽略溶液體積的變化)
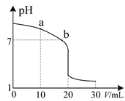
①a點所示的溶液中c(NH3·H2O)____c(Cl-)。
②b點所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水與pH=4的NH4C1溶液中,由水電離出的c(H+)之比為____。
(4)常溫下,要將ZnSO4溶液中的Zn2+沉淀完全(Zn2+的濃度小于10-5 mol·L-1),應控制溶液的pH____。(已知25℃時,Ksp[Zn(OH)2] =1.0×l0-17)
【答案】NaF CO![]() +H2S=HS-+HCO
+H2S=HS-+HCO![]() 10-1.2 < = 10-6 >8
10-1.2 < = 10-6 >8
【解析】
(1)圖表中數據分析可知酸性HF>H2CO3>H2S>HCO3->HS-,對應鹽的水解程度F-<HCO3-<HS-<CO32-<S2-;
①常溫下,PH相同的三種溶液NaF、Na2CO3、Na2S,水解程度越大的溶液濃度越小;
②將過量H2S通入Na2CO3溶液,由強酸制強酸可知反應生成NaHS和NaHCO3;
(2)二元弱酸H2A在水溶液中分步水解,則隨著溶液pH的增大,溶液中H2A的濃度逐漸減小,HA-的濃度先增大后減小,則A2-的濃度逐漸增大,故圖中三曲線分別是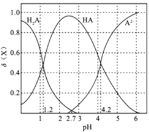 ;
;
(3)①a點加入了10mL鹽酸,反應后的溶液中含有等濃度的氨水和氯化銨,NH3H2O的電離程度大于銨根離子的水解,溶液顯示堿性;
②b點溶液pH=7,結合溶液中的電荷守恒式分析;
③常溫下,pH=10的氨水溶液中,水電離出的氫氧根離子濃度等于水電離出的氫離子濃度=10-10mol/L;pH=4的NH4C1溶液中水電離出的氫氧根離子濃度等于水電離出的氫離子濃度=10-4mol/L;
(4)依據Ksp[Zn(OH)2] =1.0×l0-17=c(Zn2+)×c2(OH-)計算。
(1)圖表中數據分析可知酸性HF>H2CO3>H2S>HCO3->HS-,對應鹽的水解程度F-<HCO3-<HS-<CO32-<S2-;
①常溫下,PH相同的三種溶液NaF、Na2CO3、Na2S,水解程度越大的溶液濃度越小,則物質的量濃度由大到小的順序為NaF>Na2CO3>Na2S,即NaF的物質的量濃度最大;
②將過量H2S通入Na2CO3溶液,由強酸制強酸可知反應生成NaHS和NaHCO3,則發生反應的離子方程式為CO![]() +H2S=HS-+HCO
+H2S=HS-+HCO![]() ;
;
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物質的量分數δ(X)隨pH的變化為 ,當pH=1.2,即c(H+)=10-1.2mol/L時,溶液中c(H2A)=c(HA-),此時H2A的電離平衡常數K1=
,當pH=1.2,即c(H+)=10-1.2mol/L時,溶液中c(H2A)=c(HA-),此時H2A的電離平衡常數K1=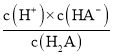 =10-1.2;
=10-1.2;
(3)①點加入的鹽酸體積為氨水體積的![]() ,等濃度的兩溶液反應后,混合液中含有等濃度的氨水和氯化銨,由于NH3H2O的電離程度大于銨根離子的水解程度,則溶液顯示堿性,則溶液中c(NH3·H2O)<c(Cl-);
,等濃度的兩溶液反應后,混合液中含有等濃度的氨水和氯化銨,由于NH3H2O的電離程度大于銨根離子的水解程度,則溶液顯示堿性,則溶液中c(NH3·H2O)<c(Cl-);
②b點時溶液pH=7,則c(H+)=c(OH-),根據電荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-),可知c(Cl- )=c(NH4+);
③常溫下,pH=10的氨水溶液中,水電離出的氫氧根離子濃度等于水電離出的氫離子濃度=10-10mol/L;pH=4的NH4C1溶液中水電離出的氫氧根離子濃度等于水電離出的氫離子濃度=10-4mol/L,pH=10的氨水與pH=4的NH4C1溶液中,由水電離出的c(H+)之比為=![]() =10-6;
=10-6;
(4)常溫下,Ksp[Zn(OH)2] =1.0×l0-17=c(Zn2+)×c2(OH-),其中c(Zn2+)=10-5 mol·L-1,則c (OH-)=![]() mol·L-1= 10-6mol·L-1,此時溶液pH=8,即應控制溶液的pH>8,可使Zn2+沉淀完全。
mol·L-1= 10-6mol·L-1,此時溶液pH=8,即應控制溶液的pH>8,可使Zn2+沉淀完全。


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】已知:T℃時,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三種鹽的沉淀溶解平衡曲線如圖所示,pM=-lgc(陰離子)、pN=-lgc(陽離子)。下列說法錯誤的是
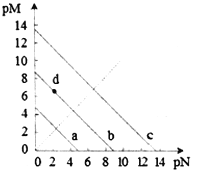
A. a線是CaSO4沉定溶解平衡曲線
B. T℃時,向10mL水中加入CaCO3和PbCO3至二者均飽和,溶液中c(Ca2+)∶c(Pb2+)=
C. d點表示CaCO3的飽和溶液。且c(Ca2+)<c(CO32-)
D. T℃時,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀會轉化為CaCO3沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蘭尼鎳是一種帶有多孔結構的細小晶粒組成的鎳鋁合金,被廣泛用作有機物的氫化反應的催化劑。以紅土鎳礦(主要成分為NiS、FeS和SiO2等)為原料制備蘭尼鎳的工藝流程如下圖所示:

(1)在形成Ni(CO)4的過程中,碳元素的化合價沒有變化,則Ni(CO)4中的Ni的化合價為___________;
(2)已知紅土鎳礦煅燒后生成Ni2O3,而加壓酸浸后浸出液A中含有Ni2+,寫出有關鎳元素的加壓酸浸的化學反應方程式______________________;
(3)向浸出液A中通入H2S氣體,反應的離子方程式是____________________;
(4)“高溫熔融”時能否將通入氬氣換為CO并說明原因_____________________;
(5)“堿浸”的目的是使鎳鋁合金產生多孔結構,從而增強對氫氣的強吸附性,此過程
中發生反應的離子方程式為___________________。浸出反應所用的NaOH溶液的濃度要大,若NaOH溶液較稀時,則會產生少量的Al(OH)3沉淀而阻止浸出反應的持續進行,請用化學反應原理加以解釋:________________________。
(6)浸出液B可以回收,重新生成鋁以便循環利用。請設計簡單的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A.打開汽水瓶有氣泡從溶液中冒出
B.黃綠色的氯水光照后顏色變淺
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡體系中加入少量鐵粉,溶液顏色變淺
Fe(SCN)3+3KCl平衡體系中加入少量鐵粉,溶液顏色變淺
D.2NO2(g)![]() N2O4(g)平衡體系中,加壓縮小體積后顏色加深
N2O4(g)平衡體系中,加壓縮小體積后顏色加深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2和H2在催化劑表面合成氨氣反應的能量變化如圖,下列說法正確的是
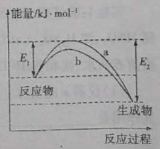
A.相同條件下,催化劑b的效果更好
B.使用催化劑,合成氨反應放出的熱量減少
C.合成氨反應中,反應物斷鍵吸收的能量大于生成物形成新鍵釋放的能量
D.催化劑在吸附N2、H2時,催化劑與氣體之間的作用力為化學鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示且與對應的敘述不相符的是( )

A.圖1表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則NaA溶液的pH小于同濃度的NaB溶液的pH
B.圖2表示 KNO3 的溶解度曲線,a點所示的溶液是80℃時KNO3的不飽和溶液
C.圖3 表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化
D.圖4表示恒溫恒容條件下,2NO2(g)![]() N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組為了研究外界條件對化學反應速率的影響,進行了如下實驗:
(實驗原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(實驗內容及記錄)
實驗編號 | 室溫下,試管中所加試劑及其用量 / mL | 室溫下溶液顏色褪至無色所需時間 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
請回答:(1)表中V1=___________,V2=___________。
(2)根據上表中的實驗數據,可以得到的結論是_____________________________。
(3)利用實驗1中數據計算,若用KMnO4的濃度變化表示的反應速率為:υ(KMnO4)= ________________________。
(4)該小組同學根據經驗繪制了n(Mn2+) 隨時間變化趨勢的示意圖,如圖1所示。但有同學查閱已有的實驗資料發現,該實驗過程中n(Mn2+) 隨時間變化的趨勢應如圖2所示。該小組同學根據圖2所示信息提出了新的假設,并繼續進行實驗探究。(忽略反應過程中溫度變化)
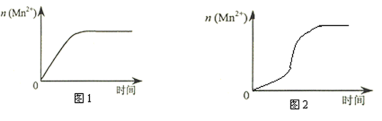
①該小組同學提出的假設是_______________________________________。
②請你幫助該小組同學完成實驗方案。
實驗編號 | 室溫下,試管中所加試劑及其用量 / mL | 再向試管中加入少量固體 | 室溫下溶液顏色褪至無色所需時間 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固體A是_______________。(寫化學式)
③若該小組同學提出的假設成立,應觀察到的現象是____________
(5)工業上可用電解K2MnO4溶液的方法制取KMnO4,則電解時,陽極發生的電極反應式為____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對傘花烴(圖I)常用作染料、醫藥、香料的中間體。下列說法錯誤的是
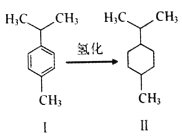
A. 常溫對傘花烴呈液態且難溶于水
B. 圖Ⅱ物質的一氯代物有5種結構
C. 對傘花烴最多有9個碳原子共平面
D. 圖中氫化反應既是加成反應又是還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定0.1 mol·L-1 Na2SO3溶液先升溫再降溫過程中的pH,數據如下。
時刻 | ① | ② | ③ | ④ |
溫度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
實驗過程中,取①④時刻的溶液,加入鹽酸酸化的BaCl2溶液做對比實驗,④產生白色沉淀多。
下列說法不正確的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH與①不同,是由于![]() 濃度減小造成的
濃度減小造成的
C. ①→③的過程中,溫度和濃度對水解平衡移動方向的影響一致
D. ①與④的Kw值相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com