


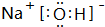 ; 用電子式表示G與Q形成化合物的過程
; 用電子式表示G與Q形成化合物的過程 ;
;分析 根據元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16個電子,有3個電子層,各層電子數為2、8、6;
(2)電子層結構相同,核電荷數越大離子半徑越小;
(3)C、O兩元素形成的化合物有CO、CO2,原子之間均形成共價鍵,二氧化碳中碳和氧原子間形成2對共用電子對;
(4)NaOH由鈉離子與氫氧根離子構成;G與Q形成化合物為Na2S,由鈉離子與硫離子構成,用Na原子、S原子電子式表示其形成;
(5)利用單質之間的相互置換反應進行驗證,如氯氣與硫化鈉反應生成硫與NaCl,可以證明Cl的非金屬性強于硫;
(6)氧化鋁為兩性氧化物,與氫氧化鈉反應生成偏鋁酸鈉和水.
解答 解:根據元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16個電子,有3個電子層,各層電子數為2、8、6,原子結構示意圖為 ,
,
故答案為:第三周期ⅥA族; ;
;
(2)電子層結構相同,核電荷數越大離子半徑越小,故離子半徑:S2->Cl->K+,故答案為:S2->Cl->K+;
(3)C、O兩元素形成的化合物有CO、CO2,原子之間均形成共價鍵,二氧化碳中碳和氧原子間形成2對共用電子對,結構式為:O=C=O,故答案為:共價鍵;O=C=O;
(4)NaOH由鈉離子與氫氧根離子構成,電子式為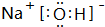 ;G與Q形成化合物為Na2S,由鈉離子與硫離子構成,用Na原子、S原子電子式表示其形成為:
;G與Q形成化合物為Na2S,由鈉離子與硫離子構成,用Na原子、S原子電子式表示其形成為: ,故答案為:
,故答案為: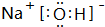 ;
; ;
;
(5)氯氣與硫化鈉反應生成硫與NaCl,可以證明Cl的非金屬性強于硫,反應方程式為:Na2S+C12=2NaC1+S↓;故答案為:Na2S+C12=2NaC1+S↓;
(6)Y的氧化物為Al2O3,與NaOH溶液反應的離子方程式為:Al2O3+2OH-═2AlO2-+H2O,故答案為:Al2O3+2OH-═2AlO2-+H2O.
點評 本題考查元素周期表與元素周期律,難度不大,關鍵是要在有一個完整準確的元素周期表判斷元素,(5)中用化學方程式說明非金屬性強弱為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下22.4 L NO與11.2 L O2混合后所得氣體分子數為6.02×1023 | |
| B. | 標準狀況下3.36 L CCl4含碳原子數為0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含電子數為9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的鹽酸中所含氯化氫分子數為2×6.02×1023 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合價 | +2 | +3 | +6、-2 | +7、-1 | -2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
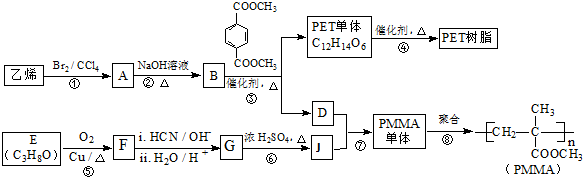 已知:
已知: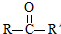 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$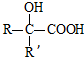 (R、R’代表烴基)
(R、R’代表烴基) .
. .
. .
.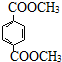 與足量NaOH溶液反應時,最多消耗4mol NaOH
與足量NaOH溶液反應時,最多消耗4mol NaOH查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯原子的結構示意圖: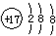 | |
| B. | N2的電子式: | |
| C. | CH4分子的比例模型: | |
| D. | 用電子式表示氯化氫分子的形成過程: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
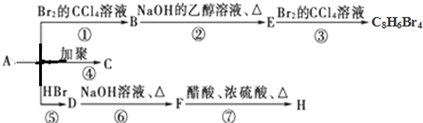
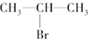 (主要產物)
(主要產物)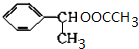 ,
,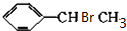 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$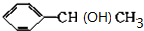 +NaBr.
+NaBr.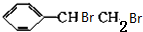 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$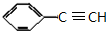 +2NaBr+2H2O
+2NaBr+2H2O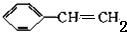 $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$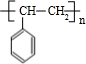 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是某興趣小組探究不同條件下化學能轉變為電能的裝置
如圖是某興趣小組探究不同條件下化學能轉變為電能的裝置查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com