
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
分析 I.(1)結合v(H2)=$\frac{△c}{△t}$計算;
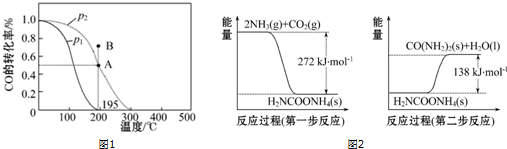
(2)根據圖象可知相同溫度下,p1時的CO轉化率小于p2時的CO的轉化率,根據化學方程式,壓強增大,平衡向右移動;B點在平衡曲線之上,反應向左進行;
(3)3 min時,反應達到平衡,氫氣的物質的量減少4mol,濃度變化量為$\frac{4mol}{20L}$=0.2mol/L,則
CO(g)+2H2(g)?CH3OH(g)
起始濃度 0.2 0.4 0
變化濃度 0.1 0.2 0.1
平衡濃度 0.1 0.2 0.1
結合平衡濃度計算K;
Ⅱ.(1)根據示意圖可知第一步反應的熱化學方程式為2NH3(g)+CO2(g)=H2NCOONH4(s)△H=-272 kJ•mol-1,第二步反應的熱化學方程式為H2NCOONH4(s)=CO(NH2)2(s)+H2O(l)△H=+138 kJ•mol-1,根據蓋斯定律,則2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)為兩步反應的和;
(2)A.該反應為放熱反應,升高溫度平衡向左移動;
B.加入催化劑,平衡不移動;
C.將尿素及時分離出去,生成物濃度減小;
D.增大反應體系的壓強,反應速率加快,平衡向右移動.
解答 解:Ⅰ.(1)v(H2)=$\frac{△c}{△t}$=$\frac{\frac{8mol-5mol}{20L}}{1min}$=0.15 mol•L-1•min-1,故答案為:0.15;
(2)根據圖象可知相同溫度下,p1時的CO轉化率小于p2時的CO的轉化率,根據化學方程式,壓強增大,平衡向右移動,CO的轉化率增大,所以p1<p2;B點在平衡曲線之上,反應向左進行,所以v(正)<v(逆),
故答案為:<;<;
(3)3 min時,反應達到平衡,氫氣的物質的量減少4mol,濃度變化量為$\frac{4mol}{20L}$=0.2mol/L,則
CO(g)+2H2(g)?CH3OH(g)
起始濃度 0.2 0.4 0
變化濃度 0.1 0.2 0.1
平衡濃度 0.1 0.2 0.1
則反應的化學平衡常數K=$\frac{0.1}{0.1×0.{2}^{2}}$=25,
故答案為:25;
Ⅱ.(1)根據示意圖可知第一步反應的熱化學方程式為2NH3(g)+CO2(g)=H2NCOONH4(s)△H=-272 kJ•mol-1,第二步反應的熱化學方程式為H2NCOONH4(s)=CO(NH2)2(s)+H2O(l)△H=+138 kJ•mol-1,根據蓋斯定律,則2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)為兩步反應的和,△H=-272 kJ•mol-1+138 kJ•mol-1=-134 kJ•mol-1,即熱化學方程式為2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134 kJ•mol-1,
故答案為:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134 kJ•mol-1;
(2)A.該反應為放熱反應,升高溫度平衡向左移動,原料利用率降低,故A錯誤;
B.加入催化劑,平衡不移動,原料利用率不變,故B錯誤;
C.將尿素及時分離出去,反應速率減小,故C錯誤;
D.增大反應體系的壓強,反應速率加快,平衡向右移動,原料利用率增大,故D正確;
故答案為:D.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、速率及K的計算、平衡移動、蓋斯定律應用等為解答的關鍵,側重分析與計算能力的考查,注意利用平衡濃度計算K,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稱量時托盤上要墊上干凈的稱量紙 | |
| B. | 移液時不慎有部分液體濺出,會造成所配溶液濃度偏小 | |
| C. | 定容時俯視容量瓶刻度線,會造成所配溶液濃度偏大 | |
| D. | 定容搖勻后發現液面下降,不應再加蒸餾水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO2和CH4是兩種主要的溫室氣體,通過CH4和CO2反應制造更高價值的化學品是目前的研究目標.
CO2和CH4是兩種主要的溫室氣體,通過CH4和CO2反應制造更高價值的化學品是目前的研究目標.| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
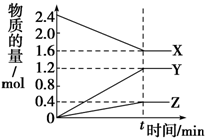 在2L容器中有3種物質進行反應,X、Y、Z的物質的量隨時間的變化曲線如圖所示,反應在t時刻達到平衡.
在2L容器中有3種物質進行反應,X、Y、Z的物質的量隨時間的變化曲線如圖所示,反應在t時刻達到平衡.| A | B | C | |
| 反應開始時濃度(mol/L) | 4.8 | 0 | |
| 2min后的濃度(mol/L) | 1.2 | 0.8 | |
| 2min內的濃度的變化(mol/L) | 0.4 | ||
| 化學學反應速率[mol/(L•min)] | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
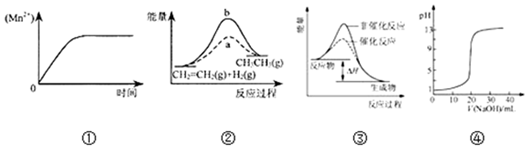
| A. | 圖①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液與過量的0.1 mol•L-1 H2C2O4溶液混 合時,n(Mn2+) 隨時間的變化 | |
| B. | 圖②中a、b曲線分別表示反應CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化 | |
| C. | 圖③表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| D. | 圖④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲線 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com