
| A. | 簡單離子半徑:Z>Y>X | B. | 氫化物的穩定性:Z>X | ||
| C. | Z的最高價氧化物可用于漂白 | D. | X與Y形成的化合物為離子化合物 |
分析 短周期元素X、Y、Z的原子序數依次遞增,Z原子最外層電子數是X原子內層電子數的3倍或者Y原子最外層電子數的3倍,則X的內層電子數為2,Z的最外層電子數為6,Y的最外層電子數為2,原子的最外層電子數之和為13,則X的最外層電子數為13-6-2=5,所以X為N,Y為Mg,Z為S,結合元素及其化合物來解答.
解答 解:短周期元素X、Y、Z的原子序數依次遞增,Z原子最外層電子數是X原子內層電子數的3倍或者Y原子最外層電子數的3倍,則X的內層電子數為2,Z的最外層電子數為6,Y的最外層電子數為2,原子的最外層電子數之和為13,則X的最外層電子數為13-6-2=5,所以X為N,Y為Mg,Z為S,
A.電子層越多,離子半徑越大,具有相同電子排布的離子,原子序數大的離子半徑小,則離子半徑為Z>X>Y,故A錯誤;
B.X為N、Z為S,氫化物分別為氨氣、硫化氫,氨氣的穩定性較強,即氫化物的穩定性:Z<X,故B錯誤;
C.Z為S元素,其最高價氧化物為三氧化硫,三氧化硫不具有漂白性,故C錯誤;
D.X為N,Y為Mg,二者形成的化合物為氧化鎂,MgO為離子化合物,故D正確;
故選D.
點評 本題考查原子結構與元素周期律的關系,題目難度中等,利用原子結構來推斷元素是解答本題的關鍵,注意短周期元素的內層電子只能為2或8,試題培養了學生的分析能力及靈活應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題
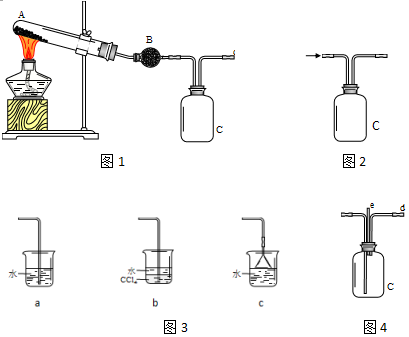
 某化學興趣小組用以下裝置探究SO2的某些化學性質.
某化學興趣小組用以下裝置探究SO2的某些化學性質.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
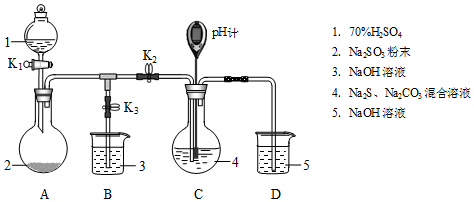
| 操作步驟 | 裝置C的實驗現象 | 解釋原因 |
| 檢查裝置氣密性后,添加藥品 | pH計讀數約為13 | 用離子方程式表示(以S2-為例): S2-+H2O?HS-+OH- |
| 打開K2,關閉K3,調節K1使硫酸緩慢勻速滴下 | ⅰ.導管口有氣泡冒出,溶液出現淡黃色渾濁,然后逐漸澄清(或渾濁減少); ⅱ.pH計讀數逐漸 減小 | 反應分步進行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(較慢) |
| 當pH計讀數接近7時,立即停止通SO2,操作是關閉K1、K2,打開K3 | / | 必須立即停止通SO2的原因是: SO2過量會使溶液酸度增加,使產物分解,降低產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(濃)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放電\;}}{\;}$ 2NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的轉化率為40% |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| ① | ② | ③ | ④ | |
| I | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com