
(10 分)
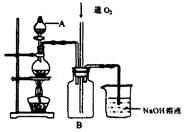
硫酸銅是一種用途廣泛的化工原料。將適量稀硝酸分多次加人到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶,得到硫酸銅晶體(裝置如圖所示)。
(1)圖中燒瓶內發生的離子反應方程式為:________________
(2)反應時B瓶內的現象是___________________________
(3)為符合綠色化學的要求,某研究性學習小組進行如下設計:
第一組:以空氣為氧化劑法
把![]() 作催化劑加人到銅粉與稀硫酸的混合物中,并通人空氣或氧氣,即發生反應。反應完全后向其中加人物質甲調節
作催化劑加人到銅粉與稀硫酸的混合物中,并通人空氣或氧氣,即發生反應。反應完全后向其中加人物質甲調節![]() ,產生
,產生![]() 沉淀,過濾、蒸發、結晶,得到硫酸銅晶體,濾渣作催化劑循環使用。
沉淀,過濾、蒸發、結晶,得到硫酸銅晶體,濾渣作催化劑循環使用。
經查閱資料得知,在溶液中通過調節溶液的酸堿性而使![]() 分別生成沉淀的pH如下:
分別生成沉淀的pH如下:
| 物質 | 開始沉淀時的PH | 完全沉淀時的PH |
| Fe(OH)3 | 1.9 | 3. 2 |
| Cu(OH)2 | 4. 7 | 6. 7 |
| Fe(OH)2 | 6. 3 | 9. 7 |
請回答下列問題:
①物質甲 是 (填字母序號)。
a. ![]() b.
b.![]() c.
c.![]() d.
d.![]()
②該方案中調節PH的范圍是 。
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)下列各項反應速度的差異,分別與哪個因素的關系最密切?
(1)硫在O2中比在空氣中燃燒劇烈: ;
(2)鹵化銀要保存在棕色試劑瓶中 ;
(3)MnO2加入雙氧化水中反應更劇烈 ;
(4)同質量的鐵片和鐵粉與足量的同濃度的鹽酸反應,后者先反應完 ;
(5)鎂粉在冷水中反應僅有微量氣泡逸出,但加熱時則有大量氣泡產生 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省余姚中學高一下學期期中考試理科化學試卷(帶解析) 題型:填空題
(10分)含硫化合物的種類很多,現有SO2、Na2SO3、H2SO4、CuSO4這4種常見的含硫化合物。回答下列問題:
(1)為進一步減少SO2的污染并變廢為寶,我國正在探索在一定條件下用CO還原SO2得到單質硫的方法來除去SO2 。寫出該反應的化學方程式: 。
(2)亞硫酸鈉和碘酸鉀在酸性溶液中發生以下反應: —
— 
①配平上面的氧化還原反應方程式.將化學計量數填入方框中。
②其中氧化劑是 ,若反應中有5 mol電子轉移,則生成的碘單質是 mol。
(3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2氣體,有白色沉淀生成。此沉淀是
| A.BaSO4 | B.FeS | C.BaSO3 | D.S |

查看答案和解析>>
科目:高中化學 來源:2014屆浙江省高一下學期期中考試理科化學試卷(解析版) 題型:填空題
(10分)含硫化合物的種類很多,現有SO2、Na2SO3、H2SO4、CuSO4這4種常見的含硫化合物。回答下列問題:
(1)為進一步減少SO2的污染并變廢為寶,我國正在探索在一定條件下用CO還原SO2得到單質硫的方法來除去SO2 。寫出該反應的化學方程式: 。
(2)亞硫酸鈉和碘酸鉀在酸性溶液中發生以下反應:
 —
— 
①配平上面的氧化還原反應方程式.將化學計量數填入方框中。
②其中氧化劑是 ,若反應中有5 mol電子轉移,則生成的碘單質是 mol。
(3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2氣體,有白色沉淀生成。此沉淀是
A.BaSO4 B.FeS C.BaSO3 D.S
(4)常溫下,將鐵棒置于濃硫酸中.無明顯現象,課本上解釋為發生了鈍化,但有人認為未發生反應。為驗證此過程,某同學經過思考,設計了如下實驗:將經濃硫酸處理過的鐵棒洗凈后置于CuSO4溶液中,若鐵棒表面 ,則發生了鈍化
查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)含硫化合物的種類很多,現有![]() 、
、![]() 、
、![]() 、
、![]() 這4種常見的含硫化合物。回答下列問題:(1)為進一步減少
這4種常見的含硫化合物。回答下列問題:(1)為進一步減少![]() 的污染并變廢為寶,我國正在探索在一定條件下用CO還原
的污染并變廢為寶,我國正在探索在一定條件下用CO還原![]() 得到單質硫的方法來除去
得到單質硫的方法來除去![]() 。寫山該反應的化學方程式: 。
。寫山該反應的化學方程式: 。
(2)亞硫酸鈉和碘酸鉀在酸性溶液中發生以下反應:
![]() ――
――![]()
①配平上面的氧化還原反應方程式.將化學計量數填入方框中。
②其中氧化劑是 ,若反應中有5 mol電子轉移,則生成的碘是 mol。
(3)常溫下,將鐵棒置于濃硫酸中.無明顯現象,課本上解釋為發生了鈍化,但有人認為未發生反應。為驗證此過程,某同學經過思考,設計了如下實驗:將經濃硫酸處理過的鐵棒洗凈后置于CuSO4溶液中,若鐵棒表面 ,則發生了鈍化。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com