
A.使濕潤的藍色石蕊試紙變紅的氣體一定是氯化氫氣體
B.某氣體通入石灰水中產生白色沉淀,再加足量的鹽酸,白色沉淀又溶解,則該氣體一定是CO2
C.常溫下向某溶液中滴加無色酚酞試液,溶液變紅,則該溶液一定是堿溶液
D.向某溶液中加入少量的KSCN溶液出現紅色,則該溶液中一定含有Fe3+
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 實驗操作 | 實驗現象 |
| 打開彈簧夾,通入一段時間CO2,關閉彈簧夾. | |
| 打開分液漏斗活塞,將濃硝酸緩慢滴入燒瓶中,關閉活塞. | 無明顯現象. |
| 加熱燒瓶,反應開始后停止加熱. | ①A中有紅棕色氣體產生,一段時間后,氣體顏色逐漸變淺; B中溶液變棕色; C中溶液紫色變淺. ②反應停止后,A中無固體剩余. |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現象 |
| ① | 第一份CuSO4溶液 | a | 溶液由藍色變為藍綠色 |
| ② | 第一份CuSO4溶液 | b | 溶液由藍色變為草綠色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由藍色變為亮綠色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現象 |
| ① | d | 第一份NaBr溶液 | 溶液由藍色變為藍綠色 |
| ② | e | 第一份NaBr溶液 | 溶液由藍色變為草綠色 |
| ③ | f | 第一份NaBr溶液 | 溶液由藍色變為亮綠色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 溫度 | 現象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由藍色變為藍綠色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由藍色變為草綠色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由藍色變為亮綠色 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 500-850℃ |
| 霧化后廢硫酸液滴直徑 | 廢硫酸完全裂解所需時間 | |
| 普通霧化器 | 800-1200/μm | 10s以上 |
| 旋轉式霧化器 | 600-850 μm | 8-10s |
| 壓縮風霧化器 | 400-650 μm | 6-7s |
| 超聲波霧化器 | 100-300μm | 3.5-5s |

查看答案和解析>>
科目:高中化學 來源: 題型:
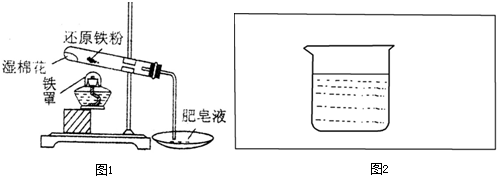
 ”表示),設計一套原電池裝置,并驗證有電流產生,請幫他在圖2方框內補充全裝置簡圖(要求標注正、負極及其材料和電解質溶液名稱).
”表示),設計一套原電池裝置,并驗證有電流產生,請幫他在圖2方框內補充全裝置簡圖(要求標注正、負極及其材料和電解質溶液名稱).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com