
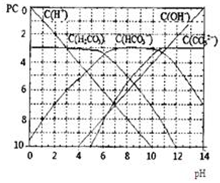
 pC類似pH,是指極稀溶液中,溶質物質的量濃度的常用對數負值.如某溶液溶質的濃度為:1×10-3mol/L,則該溶液中溶質的pC=-lg1×10-3=3.圖為H2CO3在加入強酸或強堿溶液后,平衡時溶液中三種成分的pC-pH圖.請回答下列問題:
pC類似pH,是指極稀溶液中,溶質物質的量濃度的常用對數負值.如某溶液溶質的濃度為:1×10-3mol/L,則該溶液中溶質的pC=-lg1×10-3=3.圖為H2CO3在加入強酸或強堿溶液后,平衡時溶液中三種成分的pC-pH圖.請回答下列問題:| c(H+)×c(HCO3-) |
| c(H2CO3) |
| 0.1L×0.075mol/L+0.1L×0.125mol/L |
| 0.2L |
| c(H+)×c(HCO3-) |
| c(H2CO3) |
| 10-6×10-6 |
| 10-3 |
| 0.1L×0.075mol/L+0.1L×0.125mol/L |
| 0.2L |


 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:
 pC類似pH,是指極稀溶液中溶質物質的量濃度的常用對數負值.如某溶液溶質的濃度為1×10-3mol/L,則溶液中該溶質的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC類似pH,是指極稀溶液中溶質物質的量濃度的常用對數負值.如某溶液溶質的濃度為1×10-3mol/L,則溶液中該溶質的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 此條件下,該反應達到化學平衡時,氮氣的濃度為
此條件下,該反應達到化學平衡時,氮氣的濃度為
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、某溫度下任何電解質的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐漸滴加純堿溶液,滴加過程中pC(Ca2+)逐漸減小 | C、用0.01mol/L的鹽酸滴定某濃度的NaOH溶液,滴定過程中pC(H+)逐漸增大 | D、某溫度下,AB難溶性離子化合物的Ksp=1.0×10-10,其飽和溶液中pC(A+)+pC(B-)=10 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com