
| A. | X的氣態簡單氫化物的熱穩定性比W的強 | |
| B. | 由Y、Z兩種元素組成的化合物是離子化合物 | |
| C. | W的氧化物可與Z的最高氧化物對應水化物反應 | |
| D. | 粒子半徑的大小順序:r(W)>r(X)>r(Z+)>r(Y3-) |
分析 X原子的最外層電子數是其內層電子數的2倍,應為C元素,X、W在同一主族,W應為Si元素,Z+與Y3-具有相同的電子層結構,短周期主族元素X、Y、Z、W的原子序數依次增大,則Y為N元素,Z為Na元素,以此解答該題.
解答 解:由以上分析可知X為C,Y為N,Z為Na,W為Si元素,
A.非金屬性C>Si,元素的非金屬性越強,對應的氫化物越穩定,故A正確;
B.Y、Z兩種元素組成的化合物為Na3N等,是離子化合物,故B正確;
C.W的氧化物為二氧化硅,為酸性氧化物,可與Z的最高氧化物對應水化物氫氧化鈉溶液反應,故C正確;
D.Y、Z的離子具有相同的核外電子排布,核電荷數越大離子半徑越小,應為r(Y3-)>r(Z+),故D錯誤.
故選D.
點評 本題考查原子結構和元素周期律,為高頻考點,側重考查學生的分析能力,明確物質結構、元素周期律即可解答,熟練掌握同一周期、同一主族元素性質遞變規律,題目難度不大.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:選擇題

| A. | 200℃時,反應從開始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 圖2所知反應xA(g)+yB(g)?zC(g)的△H>0,且a=1 | |
| C. | 若在圖1所示的平衡狀態下,再向體系中充入He,此時v正>v逆 | |
| D. | 200℃時,向容器中充入2mol A和1mol B,達到平衡時,A的體積分數小于0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
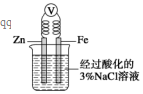
| A. | 將一小塊銅片放入盛有濃硫酸的試管中加熱反應后的溶液呈藍色 | |
| B. | 將一小塊鈉放入盛有水的燒杯中,鈉在水面上游動,同時看到燒杯內的溶液變為紅色 | |
| C. | 如圖,一段時間后給燒杯內的溶液中加入氫氧化鈉溶液,可看到Fe電極附近有紅褐色沉淀生成 | |
| D. | 向盛有少量Mg(OH)2沉淀懸濁液的試管中滴加氯化銨溶液,可看到沉淀溶解 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
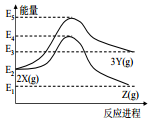
| A. | 由 X→Z 反應的△H<0 | B. | 由 X→Y 反應的△H=E5-E2 | ||
| C. | 增大壓強有利于提高 Y 的產率 | D. | 升高溫度有利于提高 Z 的產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na$→_{點燃}^{O_{2}}$Na2O2$→_{點燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{點燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{鹽酸}{→}$AlCl3 | |
| D. | S$→_{點燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,8g O2含有4NA個電子 | |
| B. | 1L 0.1mol•L-1的氨水中有0.1NA個NH4+ | |
| C. | 標準狀況下,22.4L鹽酸含有NA個HCl分子 | |
| D. | 1 mol苯乙烯中含碳碳雙鍵數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 向[Ag(NH3)2]OH溶液中加入鹽酸:Ag++Cl-═AgCl↓ | |
| B. | 向Al2(SO4)3溶液中加入過量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸洗滌試管內壁的銀鏡:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NH4HCO3溶液與足量NaOH溶液共熱:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
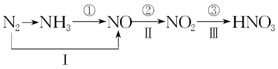 工業上硝酸的制備和自然界中硝酸的生成既有相同的地方,又有區別.線路①、②、③是工業生產硝酸的主要途徑,線路Ⅰ、Ⅱ、Ⅲ是雷電高能固氮過程中硝酸的生成途徑.
工業上硝酸的制備和自然界中硝酸的生成既有相同的地方,又有區別.線路①、②、③是工業生產硝酸的主要途徑,線路Ⅰ、Ⅱ、Ⅲ是雷電高能固氮過程中硝酸的生成途徑.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com