
【題目】丙烷的分子結構可簡寫成鍵線式結構∧,有機物A的鍵線式結構為![]() ,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
A.有機物A的一氯代物只有4種
B.用系統命名法命名有機物A,名稱為2,2,3-三甲基戊烷
C.有機物A的分子式為C8H18
D.B的結構可能有3種,其中一種的名稱為3,4,4-三甲基-2-戊烯
【答案】A
【解析】
A. 根據信息可知,A的結構簡式為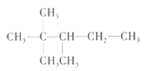 ,分子中有5種化學環境不同的氫原子,故其一氯代物有5種,A項錯誤;
,分子中有5種化學環境不同的氫原子,故其一氯代物有5種,A項錯誤;
B. 最長的主鏈含有5個C原子,從距離甲基近的一段編碳號,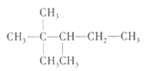 的名稱為:2,2,3-三甲基戊烷,B項正確;
的名稱為:2,2,3-三甲基戊烷,B項正確;
C. 由A的結構簡式可知,A的分子式為C8H18,C項正確;
D. A是有機物B與等物質的量的H2發生加成產物,則B中含有1個C=C雙鍵,根據加成反應還原雙鍵,A中相鄰碳原子上都含有H原子的可以含有碳碳雙鍵,故B的結構簡式可能有如下三種: 、
、 、
、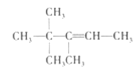 ,它們名稱依次為:3,3-二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,D項正確;
,它們名稱依次為:3,3-二甲基-2-乙基-1-丁烯、3,4,4-三甲基-1-戊烯、3,4,4-三甲基-2-戊烯,D項正確;
答案選A。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】某實驗小組欲制取 NaHSO3 晶體,設計采用如下裝置制備(省略夾持和加熱裝置)。
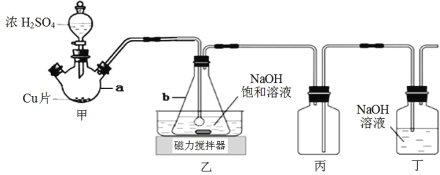
(1)儀器 b 的名稱是_____________。
(2)裝置丙的作用是_____________。
(3)裝置乙中過量的 SO2 與 NaOH 溶液反應生成 NaHSO3 晶體,其離子方程式為_____________。
(4)裝置甲中反應生成 SO2 的操作順序是_____________。
①點燃酒精燈加熱儀器 a
②打開分液漏斗上口玻璃塞
③打開分液漏斗玻璃旋塞,使濃硫酸流入 a
④關閉分液漏斗玻璃旋塞
(5)經檢驗,實驗制得的 NaHSO3 晶體中含有大量的 Na2S2O5 固體和一定量的 Na2SO3 和Na2SO4,查閱資料獲知在溶液中 NaHSO3 易發生反應生成 Na2S2O5,Na2S2O5 在空氣中、受熱時均易分解。
①試寫出反應生成 Na2S2O5 的化學方程式_____________。
②晶體中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的結構及性質說法錯誤的是( )
A.2-丁烯是石油裂解的產物之一,它存在順反異構
B.乙酸、苯酚、乙醇都可以與金屬鈉反應產生氫氣,所以它們都是電解質
C.該有機物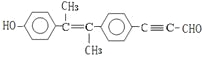 中,最多有19個碳原子共面
中,最多有19個碳原子共面
D.甲苯的硝化反應能說明側鏈對苯環的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)今有如圖所示的三種有機物:
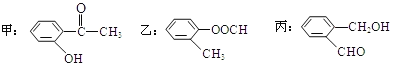
①寫出丙中含氧官能團的名稱___;
②這三種物質中,互為同分異構體的是___;
(2)由丙烯經下列反應可制得F、G兩種高分子化合物,它們都是常用的塑料。
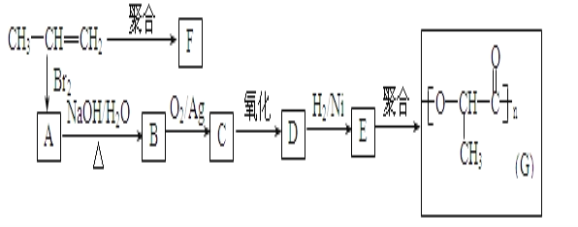
①A的同分異構體還有___種;
②聚合物F的結構簡式是___;
③B轉化為C的化學方程式是___;
④寫出與E具有相同官能團的一種同分異構體的結構簡式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物之間的相互轉化可用下式表示:Fe2+![]() Fe3+
Fe3+![]() FeO42-(高鐵酸根離子)。回答下列有關問題:
FeO42-(高鐵酸根離子)。回答下列有關問題:
(1)Fe與過量鹽酸反應可以制取FeCl2。若用反應所得的酸性溶液,實現上述①、④的轉化,要求產物純凈,可選用__________(填字母)。
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化學方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高鐵酸鉀)+3NaCl+2H2O,還原劑是______________,具有__________性。
(3)高鐵酸鉀(K2FeO4)是一種新型、高效的綠色水處理劑,在水中發生反應生成氫氧化鐵膠體。高鐵酸鉀作為水處理劑發揮的作用是___________、__________。
(4)某同學為了檢驗家中的一瓶補鐵藥(成分為FeSO4)是否變質,查閱了有關資料,得知Fe2+能被酸性高錳酸鉀溶液氧化而使高錳酸鉀溶液褪色,并結合已學的知識設計了如下實驗:將藥片除去糖衣研細后,溶解過濾,取濾液分別加入兩支試管中,在試管Ⅰ中滴入酸性高錳酸鉀溶液,在試管Ⅱ中滴入KSCN溶液。
①請你填出該同學實驗中出現以下現象時應得出的結論:
實驗現象 | 試管Ⅰ | 試管Ⅱ | 結論 |
a | 褪色 | 不變紅 | ___ |
b | 不褪色 | 變紅 | ___ |
c | 褪色 | 變紅 | ___ |
②能不能將KMnO4和KSCN滴入到同一試管中進行驗證,為什么?試進行解釋:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的化工原料,在工農業生產、生活中有著重要的應用。請你根據所學知識回答下列問題:
(1)把氯氣通入紫色石蕊溶液中,可以觀察到的現象是_________;
(2)氯氣與水反應生成次氯酸(HClO)具有殺菌作用,常用于自來水消毒。請寫出氯氣與水反應的化學方程式:___________,在該反應中氧化產物是_________,還原產物是____________。
(3)某化學興趣小組計劃用氯氣和氫氧化鈉制取簡易消毒液。其反應原理為(用化學方程式表示):_________。
(4)某同學幫助水質檢測站配制480 mL 0.5 mol·L-1NaOH溶液以備使用:
①該同學應稱取NaOH固體__________ g;
②上述實驗除了需要托盤天平、藥匙、燒杯、玻璃棒、量筒等儀器外,還需要的儀器有_______。
③下列操作使配制的NaOH溶液濃度偏低的有__________。
A.將砝碼放在左盤上,NaOH放在右盤上進行稱量
B.定容的仰視刻度線
C.定容搖勻后,液面下降,又加水至刻度線
D.整個配制過程中,容量瓶不振蕩
(5)取上述配制的NaOH溶液______ L才能與0.224 L 氯氣(標準狀況下)恰好完全反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖所示實驗,回答問題:
(1)實驗①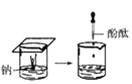 觀察到的現象是________________________。實驗②
觀察到的現象是________________________。實驗②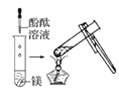 觀察到的現象是________________________。
觀察到的現象是________________________。
(2)實驗③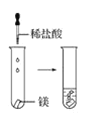 觀察到的現象是________________________。實驗④
觀察到的現象是________________________。實驗④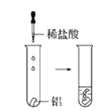 觀察到的現象是________________________。
觀察到的現象是________________________。
(3)由上述實驗,你能得出的結論是________________________。
(4)請總結同周期元素金屬性的變化規律__________,并用原子結構解釋其原因_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應mA(s) + nB(g) eC(g) + fD(g),反應過程中,當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如下圖,下列敘述不正確的是 ( )
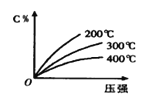
A.化學方程式中n > e+f
B.達到平衡后,若升溫,平衡左移
C.到平衡后,加入催化劑C%不變
D.達到平衡后,增加A的質量有利于平衡向右移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
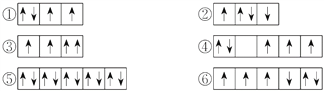
(2)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(3)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】試題分析:(1)在一個原子軌道里,最多只能容納2個電子,而且它們的自旋狀態相反,稱為泡利不相容原理;當電子排布在同一個能級的不同軌道時,基態原子中的電子總是單獨優先占據一個軌道,而且自旋狀態相同,稱為洪特規則;(2)根據激發態原子核外電子排布式知該元素核外有16個電子,根據能量最低原理分析其基態原子核外電子排;(3)相同電子層上原子軌道能量的高低:ns<np<nd;形狀相同的原子軌道能量的高低:1s<2s<3s<4s……。
解析:(1)在一個原子軌道里,最多只能容納2個電子,而且它們的自旋狀態相反,稱為泡利不相容原理,所以違反泡利不相容原理的有③;當電子排布在同一個能級的不同軌道時,基態原子中的電子總是單獨優先占據一個軌道,而且自旋狀態相同,稱為洪特規則,所以違反洪特規則的有②④⑥;(2)根據激發態原子核外電子排布式知該元素核外有16個電子,為S元素;根據能量最低原理,其基態原子核外電子排是1s22s22p63s23p4;S元素最外層有6個電子,所以最高價是+6價,最高價氧化物對應水化物的化學式是H2SO4;(3)相同電子層上原子軌道能量的高低:ns<np<nd;形狀相同的原子軌道能量的高低:1s<2s<3s<4s……,多電子原子的原子軌道按軌道能量由低到高順序是①④⑥③②⑤。
【題型】綜合題
【結束】
18
【題目】四種短周期元素A、B、C、D的性質或結構信息如下。
信息①:原子半徑大小:A>B>C>D
信息②:四種元素之間形成的某三種分子的比例模型及部分性質:
|
|
|
是地球上最常見的物質之一,常溫為液態,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分 | 無色,無味且易燃,是21世紀的主要能源 | 弱酸,有強氧化性,可以用于消毒殺菌 |
請根據上述信息回答下列問題。
(1)甲、乙、丙中含有的共同元素是 (填名稱)。
(2)B元素在周期表中的位置為 。
(3)上述元素的原子M層有一個未成對p電子的是 (填元素符號)。
(4)丙的電子式為 ,丙與SO2水溶液可發生氧化還原反應,生成兩種強酸,化學反應方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com