
| A. | 加熱NaHSO4至熔化NaHSO4═Na++H++SO42- | |
| B. | 把CaO放入水中CaO═Ca2++O2- | |
| C. | HClO═H++ClO- | |
| D. | H2S?H++HS-;HS-?H++S2- |
分析 A.亞硫酸氫鈉熔融狀態電離生成鈉離子和硫酸氫根離子;
B.氧化鈣與水反應生成氫氧化鈣;
C.次氯酸為弱酸,部分電離;
D.硫化氫為多元弱酸分步電離.
解答 解:A.加熱NaHSO4至熔化,電離方程式:NaHSO4═Na++HSO4-,故A錯誤;
B.氧化鈣與水反應生成氫氧化鈣,離子方程式:CaO+H2O═Ca2++2OH-,故B錯誤;
C.次氯酸為弱酸,部分電離,離子方程式:HClO?H++ClO-,故B錯誤;
D.硫化氫為多元弱酸分步電離,電離方程式:H2S?H++HS-;HS-?H++S2-,故D正確;
故選:D.
點評 本題考查了電解質電離方程式書寫,明確電解質強弱及電離方式是解題關鍵,注意多元弱酸分步電離,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 必為第1層 | B. | 只能是第2層 | C. | 只能是第3層 | D. | 可以是任意層 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 LNH3中含有的氫原子數為3NA | |
| B. | 標準狀況下,足量Na2O2和11.2LCO2反應,轉移電子數目為NA | |
| C. | 常溫常壓下,16g CH4中所含中子數為10NA | |
| D. | 常溫常壓下,2.8g乙烯中含有碳氫鍵的數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑤ | B. | ②③⑤ | C. | ②③④⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
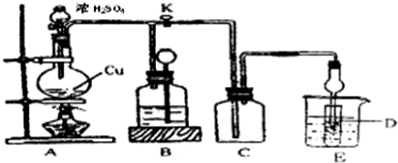
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
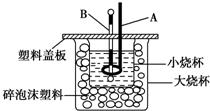 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有關中和反應的問題.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有關中和反應的問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com