
分析 將等物質的量的A、B混合于2L的密閉容器中,經過5分鐘后,測得D的濃度為0.5mol/L,生成D的物質的量為0.5mol/L×2L=1mol,則:
3A(g)+B(g)=xC(g)+2D(g)
起始量(mol):a a 0 0
變化量(mol):1.5 0.5 0.5x 1
5min后(mol):a-1.5 a-0.5 0.5x 1
5min后c(A):c(B)=3:5,則(a-1.5):( a-0.5)=3:5,解得a=3.
(1)根據c=$\frac{n}{V}$計算5min后A的濃度;
(2)由分析可知A、B起始物質的量;
(3)根據v=$\frac{△c}{△t}$計算v(B);
(4)結合C的速率計算x的值.
解答 解:將等物質的量的A、B混合于2L的密閉容器中,經過5分鐘后,測得D的濃度為0.5mol/L,生成D的物質的量為0.5mol/L×2L=1mol,則:
3A(g)+B(g)=xC(g)+2D(g)
起始量(mol):a a 0 0
變化量(mol):1.5 0.5 0.5x 1
5min后(mol):a-1.5 a-0.5 0.5x 1
5min后c(A):c(B)=3:5,則(a-1.5):( a-0.5)=3:5,解得a=3.
(1)5min后A的濃度為$\frac{(3-1.5)mol}{2L}$=0.75mol/L,
答:5min后A的濃度為0.75mol/L;
(2)由上述分析,可知A、B起始物質的量為3mol,
答:A、B起始物質的量為3mol;
(3)v(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
答:B的平均反應速率為0.05mol/(L.min);
(4)0.5x mol=0.1mol/(L•min)×5min×2L,解得x=2,
答:x的值為2.
點評 本題考查化學平衡計算,難度不大,注意三段式解題法在化學平衡計算中應用.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:選擇題
| A. | CO2在高壓、低溫下變成雪狀固體 | |
| B. | CO2通入澄清的石灰水,石灰水變渾濁 | |
| C. | CO2通入紫色石蕊試液,試液變紅色 | |
| D. | CO2通過赤熱的炭變成CO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.
2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.| 溫度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
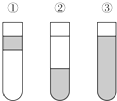 在盛有溴水的三支試管中分別加入苯、四氯化碳和酒精,振蕩后靜置,出現如圖所示的現象,正確的結論是( )
在盛有溴水的三支試管中分別加入苯、四氯化碳和酒精,振蕩后靜置,出現如圖所示的現象,正確的結論是( )| A. | ①加CCl4 ②加苯 ③加酒清 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MnO2與濃鹽酸混合加熱:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | (NH4)2Fe(SO4)2溶液中加入過量的NaOH溶液:Fe2++2OH-=Fe(OH)2↓ | |
| C. | Ba(HCO3)2溶液中加入稀硫酸:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO${\;}_{4}^{-}$+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com