
a、b、c、d是四種短周期元素。a、b、d同周期,c、d同主族且c比d少一個電子層。a的原子結構示意圖如下左圖,b與c形成化合物的電子式如下右圖。下列比較中正確的是


| A.原子半徑b>a>d | B.單質的氧化性a>c>d |
| C.最高價氧化物的熔點a>d>b | D.最高價含氧酸的酸性d>c>a |
A
解析考點:原子結構與元素周期率的關系.
專題:元素周期律與元素周期表專題.
分析:由a的原子結構示意圖中最內層電子數為x,則x為2,即a原子序數為14為硅元素;從b與c形成電子式結合a、b、d同周期可知b為鈉元素,c氮元素,因c、d同主族,所以d為磷元素.即a、b、c、d是四種短周期元素在周期表中位置為: ,根據元素周期律回答各選項.
,根據元素周期律回答各選項.
A、利用原子半徑和元素在周期表中的位置關系來解答;
B、利用原子的氧化性變化規律來分析;
C、利用熔點和物質晶體類型關系來分析;
D、利用非金屬性和最高價含氧酸關系來分析.
解答:由a的原子結構示意圖中最內層電子數為x,則x為2,即a原子序數為14為硅元素;從b與c形成電子式結合a、b、d同周期可知b為鈉元素,c氮元素,因c、d同主族,所以d為磷元素.即a、b、c、d是四種短周期元素在周期表中位置為: ,
,
A、根據半徑變化規律,同周期從左到右半徑增大,同主族從上到下半徑增大可知原子半徑大小關系為:b>a>d>c,故A錯誤;B、根據非金屬變化規律,非金屬性:N>P>Si,所以原子氧化性順序為:c>d>a,故B錯誤;C、二氧化硅為原子晶體,熔點很高,氧化鈉或過氧化鈉為離子晶體,熔點較高,五氧化二磷為分子晶體,熔點較低,最高價氧化物的熔點:a>b>d,故C錯誤;D、硝酸為強酸,磷酸為中強酸,硅酸為弱酸,最高價含氧酸的酸性c>d>a,故D正確,選D。
點評:本題考查了元素推斷及元素性質和元素原子結構、元素在周期表位置關系,推斷元素是關鍵,充分利用元素在周期表中的位置和元素性質之間關系進行解題。


 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:
 ,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題:

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
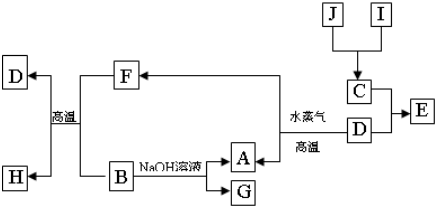
| ||
| ||
| ||
| ||
 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
 ,b與c形成化合物的電子式為
,b與c形成化合物的電子式為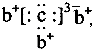 下列比較中正確的是( )
下列比較中正確的是( )| A、原子半徑:a>c>d>b | B、最高價含氧酸的酸性c>d>a | C、原子序數:a>d>b>c | D、單質的氧化性a>b>d>c |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com