
分析 ①鹽酸的酸性強于碳酸,可利用碳酸鈣與鹽酸反應生成二氧化碳、氯化鈣、水;
②利用Zn與稀硫酸反應生成硫酸鋅、氫氣;
③可溶性銅鹽與強堿反應生成氫氧化銅.
解答 解:①利用碳酸鈣與鹽酸反應生成二氧化碳、氯化鈣、水,離子反應為:CaCO3+2H+═Ca2++CO2↑+H2O,
故答案為:CaCO3+2H+═Ca2++CO2↑+H2O;
②利用Zn與稀硫酸反應生成硫酸鋅、氫氣,離子反應為:Zn+2H+═H2↑+Zn2+,
故答案為:Zn+2H+═H2↑+Zn2+;
③可溶性銅鹽與強堿反應生成氫氧化銅、如CuSO4、Ba(OH)2之間的反應,該反應為CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓,離子反應為:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓,
故答案為:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓.
點評 本題考查離子反應方程式的書寫,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重常見氣體的制取、離子反應意義的考查,注意答案不唯一,題目難度不大.


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:實驗題
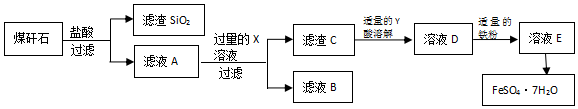
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下,由水電離出c(OH-)=1×10-12 mol•L-1的溶液中:K+、HCO3-、Na+、Cl- | |
| B. | 含有0.1 mol•L-1 Fe2+的溶液中:NH4+、SO42-、H+、NO3- | |
| C. | 使甲基橙變紅的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 室溫下,pH=1的溶液中:Na+、Cl-、K+、CH3COO- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何氣體都約是22.4L | |
| B. | 1mol氣態物質,當體積約為22.4L時,該氣體一定處于標準狀況下 | |
| C. | 在標準狀況下,2mol酒精(CH3CH2OH)的體積為44.8L | |
| D. | 常溫常壓下,質量為32g的O2含有的原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在鹵代烴中直接加入稀硝酸酸化的AgNO3溶液,產生白色沉淀 | |
| B. | 加入NaOH的乙醇溶液,加熱后加入AgNO3溶液,產生白色沉淀 | |
| C. | 加蒸餾水,充分攪拌后,加入AgNO3溶液,產生白色沉淀 | |
| D. | 加入NaOH溶液,加熱一段時間后冷卻,加入稀硝酸酸化,然后加入AgNO3溶液,產生白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
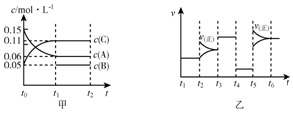 向某密閉容器中加入0.15mol/A、0.05mol/LC和一量的B三種氣體.一定條件下發生反應,各物質濃度隨時間變化如圖中甲圖所示[t0時c(B)未畫出,t1時增大到0.05mol/L].乙圖中t2時刻后改變反應條件,平衡體系中正、逆反應速率隨時間變化的情況.
向某密閉容器中加入0.15mol/A、0.05mol/LC和一量的B三種氣體.一定條件下發生反應,各物質濃度隨時間變化如圖中甲圖所示[t0時c(B)未畫出,t1時增大到0.05mol/L].乙圖中t2時刻后改變反應條件,平衡體系中正、逆反應速率隨時間變化的情況.| T1~t2 | T3~t4 | T4~t5 | T6~t |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | X | Y | Z | M | R |
| 原子半徑/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合價 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 離子半徑大小:Y2->M2->R3+ | |
| B. | Z與M組成的化合物是形成酸雨的原因之一 | |
| C. | 將YM2通入BaCl2溶液中有大量白色沉淀產生 | |
| D. | 含元素R的某種鹽可作凈水劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
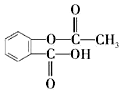
| A. | 乙酰水楊酸的分子式為C9H10O4 | |
| B. | 1mol乙酰水楊酸能與5molH2發生加成反應 | |
| C. | 1mol乙酰水楊酸在NaOH溶液中能與3mol NaOH反應 | |
| D. | 用烴基(-C4H9)取代乙酰水楊酸苯環上的氫原子,最多能形成4種同分異構體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com