

分析 (1)①甲中A、B溫度相同且體積相同,將2mol SO3完全轉化到左邊可以得到2mol SO2和1mol O2,則A、B為完全等效平衡,平衡時的反應速率相等;
②若在A充入2mol SO2和2mol O2,平衡后有amol SO3,則:
2SO2(g)+O2(g)?2SO3(g)
開始(mol):2 2 0
轉化(mol):a 0.5a a
平衡(mol):2-a 2-0.5a a
據此可以計算平衡時SO3在混合氣體中的體積分數;
恒溫恒容下,在A充入2mol SO2和2mol O2,等效為在①中平衡后再充入1mol O2,與①中平衡相比,平衡正向移動,但平衡時三氧化硫的體積分數與二氧化硫的轉化率有關,三氧化硫的體積分數變化不能確定;
B充入xmol SO2,y mol O2和1mol SO3,要使得B中反應達平衡后仍有amol SO3,完全轉化到左邊滿足SO2為2mol,O2為2mol;
(2)①如果對容器加熱,使A內氣體溫度升高,A內氣體體積增大,而后平衡向逆反應進行;
②若在A中再充入一定量Ar,瞬間導致體積增大,平衡移動不能消除濃度減小;
③若再往A內迅速充入2mol SO2和1 mol O2,等效為在原平衡基礎增大壓強,與原平衡相比平衡正向移動.
解答 解:(1)①甲中A、B溫度相同且體積相同,將2mol SO3完全轉化到左邊可以得到2mol SO2和1mol O2,則A、B為完全等效平衡,平衡時對應組分的濃度相等,平衡時的反應速率相等,則平衡后兩部分的速率大小為vA=vB,
故答案為:=;
②若在A充入2mol SO2和2mol O2,平衡后有amol SO3,則:
2SO2(g)+O2(g)?2SO3(g)
開始(mol):2 2 0
轉化(mol):a 0.5a a
平衡(mol):2-a 2-0.5a a
則平衡時SO3在混合氣體中的體積分數為$\frac{a}{2-a+2-0.5a+a}$=$\frac{2a}{8-a}$;
恒溫恒容下,在A充入2mol SO2和2mol O2,等效為在①中平衡后再充入1mol O2,與①中平衡相比,平衡正向移動,但平衡時三氧化硫的體積分數與二氧化硫的轉化率有關,三氧化硫的體積分數變化不能確定;
B充入xmol SO2,y mol O2和1mol SO3,要使得B中反應達平衡后仍有amol SO3,完全轉化到左邊滿足SO2為2mol,O2為2mol,則:x+1=2,y+$\frac{1}{2}$×1=2,故x=1、y=1.5,
故答案為:$\frac{2a}{8-a}$;無法確定;1;1.5;
(2)①如果對容器加熱,使A內氣體溫度升高,A內氣體體積增大,活塞向下移動,而后平衡向逆反應進行,活塞繼續向下移動,最后到達平衡,
故答案為:活塞向下移動,而后靜止;
②若在A中再充入一定量Ar,瞬間體積增大,反應混合物濃度減小,但平衡移動不能消除濃度減小,則達到新平衡時O2的濃度變小,
故答案為:變小;
③若再往A內迅速充入2mol SO2和1 mol O2,等效為在原平衡基礎增大壓強,與原平衡相比平衡正向移動,再次平衡時壓強、濃度均增大,則活塞再次保持靜止時,SO2的反應速率v與原平衡SO2的反應速率v0的大小關系為v>v0,同時SO2轉化率比原平衡時增大,
故答案為:>;增大.
點評 本題考查化學平衡計算、等效平衡等,關鍵是對等效平衡規律的理解,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 一定溫度和壓強下,各種氣態物質體積的大小由構成氣體的分子大小決定 | |
| B. | 一定溫度和壓強下,各種氣態物質體積的大小由構成氣體的分子數決定 | |
| C. | 不同的氣體,若體積不同,則它們所含的分子數也不同 | |
| D. | 常溫常壓下,相同粒子數的CuO、H2O、O2的體積相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 、B
、B 、C
、C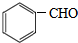 、F
、F ;
; $→_{△}^{濃H_{2}SO_{4}}$
$→_{△}^{濃H_{2}SO_{4}}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 25℃時,將一定量的冰醋酸(即無水乙酸)加水稀釋,稀釋過程中溶液的導電性變化如圖所示.則下列說法正確的是( )
25℃時,將一定量的冰醋酸(即無水乙酸)加水稀釋,稀釋過程中溶液的導電性變化如圖所示.則下列說法正確的是( )| A. | 醋酸的電離平衡常數:a<b<c | |
| B. | 溶液中n(H+):b>a>c | |
| C. | a、b、c三點的溶液都有:c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 從c點到b點,醋酸的電離度不斷增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸發操作時,當溶液中出現較多固體應停止加熱 | |
| B. | 蒸餾操作時,應使溫度計水銀球靠近蒸餾燒瓶的支管口處 | |
| C. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| D. | 如果沒有試管夾,可以臨時手持試管給固體或液體加熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com